Introdução:
A sarcoidose é uma doença granulomatosa crónica, multisistémica, com envolvimento predominante dos pulmões e gânglios linfáticos. É característica desta doença a presença de granulomas não caseosos.1
A inflamação com formação de granulomas é um achado comum, relacionado com múltiplas doenças infeciosas e não infeciosas. É raro encontrar granulomas em associação a tumores malignos e é necessário excluir todas as etiologias possíveis para que o diagnóstico de reação sarcóide possa ser estabelecido.2 Nestes casos, a reação granulomatosa pode ser idiopática, ser uma reação de tipo corpo estranho a material necrótico ou procedimento prévio, podendo, também, estar associada a terapêutica realizada, a doença sistémica ou a metástases. No entanto, na maioria dos casos, a causa específica não é identificada.3
O termo reação sarcóide neoplásica é utilizado para descrever casos em que existem características radiológicas e histológicas semelhantes a sarcoidose clássica, mas que se desenvolvem em doentes com neoplasias e sem manifestações clínicas.4-6
Já a distinção entre reação sarcoide neoplásica e sarcoidose é, em contexto de doença neoplásica atual ou recente, difícil ou mesmo impossível.3
Em doentes com neoplasias que realizam tomografia com emissão de positrões (PET), há suspeita de reação sarcóide neoplásica em 1,1%, sendo o diagnóstico confirmado em 0,6% dos casos. Com o aumento do uso da PET nos doentes oncológicos é essencial ter em conta esta entidade rara, para evitar uma interpretação errada de doença metastática. Embora esta reação seja comum nos gânglios loco-regionais que drenam o tumor, também pode ser encontrada no estroma do tumor primário, na medula óssea, em gânglios à distância, no fígado e no baço. Raramente, podem ser encontrados simultaneamente com metastização ganglionar.4,6
Tal como o mecanismo envolvido na formação dos granulomas, também o seu significado prognóstico permanece desconhecido.
Caso clínico:
Os autores apresentam o caso de um homem de 70 anos, assintomático, com seguimento em consulta na sequência de adenocarcinoma do cego, com doença metastática em um gânglio, classificado como T3N1M0, que foi submetido a hemicolectomia direita e a quimioterapia com capecitabina. No mesmo tempo operatório, foi excisado um tumor neuroendócrino do pâncreas, bem diferenciado, tendo realizado excisão completa, cuja análise histopatológica descreve tumor bem diferenciado com comportamento benigno, com 1,2 cm de maior eixo, limitado ao pâncreas, sem invasão vascular e com Ki67 inferior a 2%.
Após dois anos de seguimento, na sequência de elevação do antigénio específico da próstata (PSA) foi diagnosticado adenocarcinoma bem diferenciado da próstata (Gleason 6), tendo sido submetido a prostatectomia radical, com excisão de nove gânglios linfáticos, que não apresentavam doença metastática (pT2aN0M0).
No ano seguinte, realizou tomografia computorizada toraco-abdominal que identificou múltiplas adenopatias mediastínicas, hilares e abdominais. Foi pedida PET com 18F-FDG que revelou: foco de hipercapatação na topografia da cabeça do pâncreas, adenopatias hipermetabólicas, supra-claviculares, mediastino-hilares e abdominais, e focos de hipercaptação distribuídos pelo esqueleto, suspeitos de metástases ósseas; no lobo inferior do pulmão direito, um nódulo de 11mm compatível com granuloma, estrias fibróticas e enfisema centrilobular. Esteestudo foi considerado suspeito de metastização óssea e ganglionar supra-clavicular, mediastino-hilar e abdominal. Foi submetido a biópsia medular óssea, que revelou em vários espaços medulares a presença de granulomas epitelioides com inúmeras células gigantes do tipo Langhans, coloração de Ziehl-Neelsen negativa, sendo compatível com mielite granulomatosa, com granulomas do tipo sarcoide (Fig. 1). Realizada, também, biópsia excisional de gânglio linfático, que revelou substituição da morfologia habitual do gânglio por granulomas epitelioides não necrotizantes e raramente confluentes, com raras células gigantes multinucleadas de Langhans, compatível com doença granulomatosa (Fig. 2).
O doente apresentava um excelente estado geral, e ao exame físico apenas se detetava adenopatia supraclavicular esquerda palpável, com consistência duro-elástica, com aproximadamente 1 cm. Analiticamente, sem elevação de marcadores tumorais, nomeadamente CEA, CA 19.9, cromogranina A e PSA; enzima de conversão da angiotensina de 78 U/L (valor de referência: 8 a 52 U/L).
Após cinco meses de terapêutica com prednisolona, 40mg por dia, foi suspensa a corticoterapia e repetiu PET, que revelou ausência de foco de captação na topografia da cabeça do pâncreas (Fig. 3), persistência de adenopatias hipermetabólicas supra-claviculares esquerdas, mediastino-hilares bilaterais e abdominais, com redução numérica, dimensionalmente estabilizadas e, globalmente, com alguma redução da sua extensão e menor grau de atividade metabólica; persistência de alguns focos de hipercaptação de 18F-FDG dispersos pelo esqueleto axial e apendicular proximal, em menor número e, globalmente, com redução do grau de atividade metabólica (Fig. 4); aparecimento de lesões hipodensas hipermetabólicas no baço. No seu conjunto, e tendo em conta o comportamento funcional evolutivo das alterações descritas, o estudo foi considerado compatível com doença inflamatória em atividade, nomeadamente sarcoidose, com envolvimento ganglionar, esplénico, pancreático e medular/ósseo.
Cinco anos após o diagnóstico de reação sarcóide neoplásica e na ausência de tratamento, o doente mantém-se assintomático e sem evidência de recidiva neoplásica.
Discussão:
A presença de granulomas nos gânglios linfáticos que drenam tumores são um fenómeno raro, mas conhecido. O seu significado prognóstico permanece desconhecido. Raramente podem ser encontrados simultaneamente com metastização ganglionar. Esta reação pode-se desenvolver no estroma do tumor, em gânglios linfáticos que o drenam ou em outros órgãos como baço, pele e medula óssea.Existem várias teorias etiopatogénicas para a reação sarcóide neoplásica. Alguns autores sugerem que existe relação com sarcoidose clássica, uma vez que os granulomas partilham o mesmo padrão CD4 e CD8. Também o padrão imunohistoquímico dos linfócitos estudados é o mesmo. Outra teoria estabelece a possibilidade de se tratar de um processo imunológico, no caso dos gânglios linfáticos que drenam o tumor, uma resposta aos antigénios solúveis do mesmo, e, no caso de formação de granulomas no estroma do tumor uma reação mediada por células T aos antigénios de superfície das células tumorais. Alguns autores defendem que representa antes uma reação a corpo estranho, pela presença de um produto não degradável, resultante de material necrótico do tumor ou secundário ao tratamento realizado. Outro possível mecanismo consiste na reação tecidular à presença de células tumorais no sistema linfático ou nos capilares.7
A tomografia computorizada não permite distinguir entre reação sarcoide/sarcoidose e recorrência da neoplasia. A PET também não permite distinguir estas duas entidades, mas é uma ferramenta útil para a seleção do melhor local para biópsia. O diagnóstico diferencial entre metastização e reação sarcóide neoplásica é clinicamente muito importante. A confirmação histopatológica é mandatória, uma vez que é o único exame que permite fazer essa distinção.3,8
O caso apresentado torna-se especialmente desafiante pelos antecedentes do doente, pelo risco da coexistência de metastização. Para esclarecimento do caso foi fundamental a realização da biópsia ganglionar e medular óssea, excluindo metastização e demonstrando a presença de reação granulomatosa, o que alterou a abordagem terapêutica.
Embora a reação sarcóide neoplásica surja, por vezes, muito tempo após o diagnóstico da neoplasia, com frequência observa-se regressão espontânea, em alguns casos num curto período de tempo.6 Estão também descritos casos em que a regressão das adenopatias ocorreu com o tratamento da neoplasia e outros em que houve resposta favorável à corticoterapia, como foi parcialmente observado no nosso caso, com regressão da atividade metabólica das lesões na PET.6,9,10 No entanto, não estão definidos na literatura critérios para início de corticoterapia, dose, ou tempo de tratamento.
Uma vez que o doente se mantém assintomático, optámos por não realizar mais nenhum tratamento adicional e manter repetição anual de PET e de marcadores tumorais. Também não existem dados na literatura que suportem qual o seguimento mais adequado nestes casos.
São, portanto, necessários mais estudos de forma a compreender o significado prognóstico, em que casos a corticoterapia está indicada e qual o seguimento mais adequado para estes doentes.
Figura I
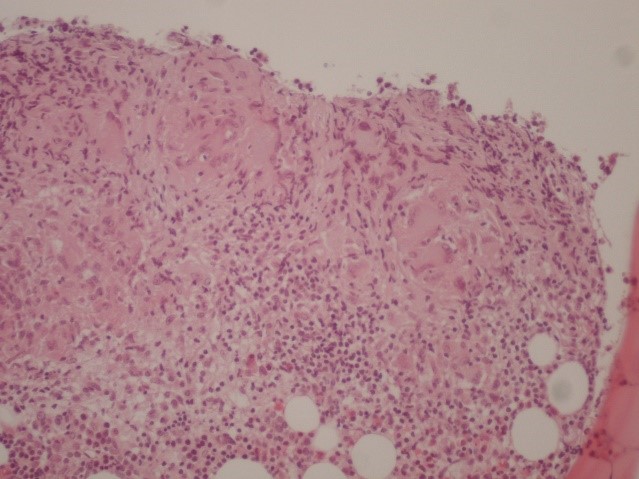
Figura 1: Biópsia medular óssea revelando presença de granulomas epitelióides com inúmeras células gigantes do tipo Langhans.
Figura II
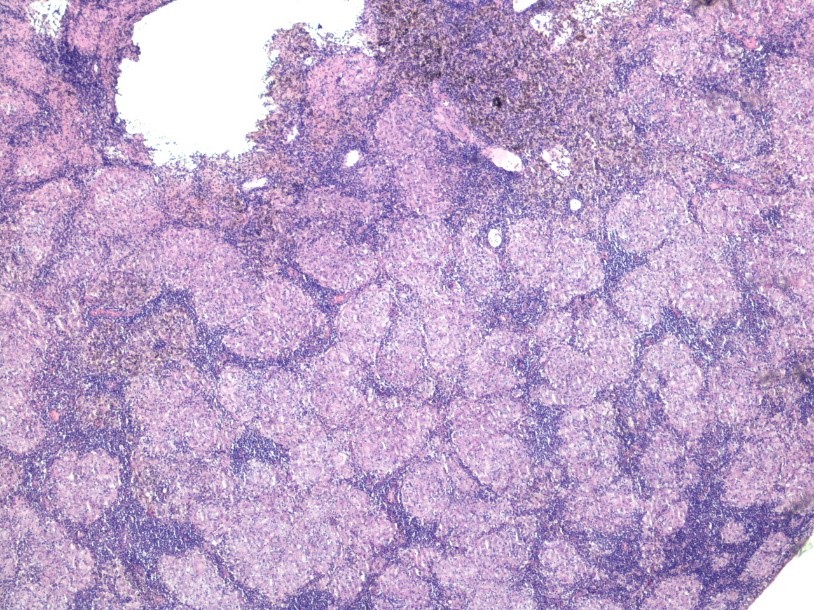
Figura 2: Biópsia ganglionar com morfologia habitual substituída por granulomas epitelióides não necrotizantes, com raras células gigantes multinucleadas de Langhans.
Figura III
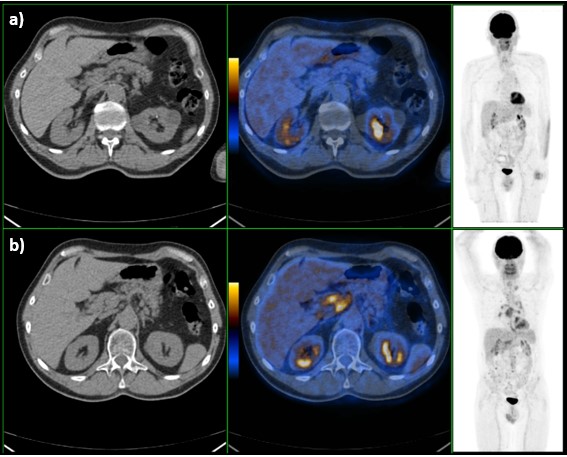
Figura 3: Imagem de PET com 18F-FDG com ausência de captação na topografia da cabeça do pâncreas (a), comparativamente ao exame inicial (b).
Figura IV
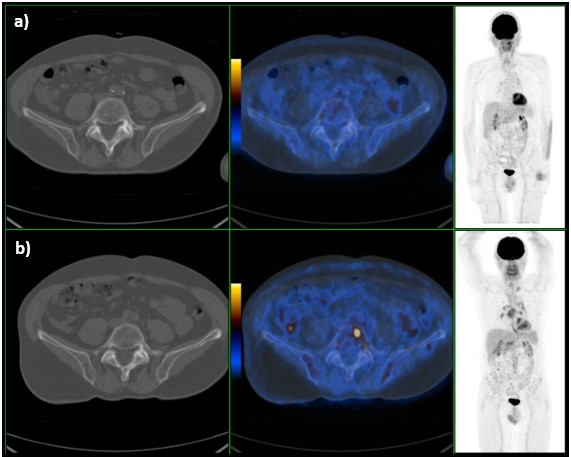
Figura 3: Imagem de PET com 18F-FDG com ausência de captação no corpo vertebral (a), comparativamente ao exame inicial (b).
BIBLIOGRAFIA
1. Newman LS, Rose CS, Maier LA. Sarcoidosis. N Eng J Med 1997;336:1224-34.
2. Brincker H. Sarcoid reactions in malignant tumours. Cancer Treat Rev 1986;13:147-56.
3. Pisciolo I, Donato S, Morelli L, et al. Renal cell carcinoma with sarcomatoid features and peritumoral sarcoid-like granulomatous reaction: report of a case and review of literature. Int J Surg Pathol 2008;16:345-8.
4. Chowdhury FU, Sheerin F, Bradley KM, Gleeson FV. Sarcoid-like reaction to malignancy on whole-body integrated 18F-FDG PET/CT: prevalence and disease pattern. Clinical Radiology 2009; 64, 675-81.
5. Lau RK, Takasugi JE, David Godwin J, et al. Sarcoid-like reaction-computed tomography features in 12 patients. J Comput Assist Tomogr 2015;39(2):143–8.
6. Kaneko Y, Kato H, Matsuo M. Hilar and mediastinal sarcoid‑like reaction after the treatment of malignant tumors: imaging features and natural course on 18F‑FDG‑PET/CT. Japanese Journal of Radiology 2018;1867-1071.
7. Arco CD, Aceñero MJF. Sarcoid reaction: a rare occurrence associated to colon adenocarcinoma (case report and literature review). J Gastrointest Oncol 2016;7(4):E72-E76.
8. Lequoy M, Coriat R, Rouquette A, et al. Sarcoidosis Lung Nodules in Colorectal Cancer Follow-up: Sarcoidosis or Not?. The American Journal of Medicine 2013;126:642-5.
9. Gregorio M, Brett AJ. Metastatic sigmoid colon adenocarcinoma and tumour-related sarcoid reaction. Internal Medicine Journal 2018;48:876–8
10. Jespersen H, Bjursten S, Ny L, et al. Checkpoint inhibitor-induced sarcoid reaction mimicking bone metastases. Lancet Oncol 2018; 19: e327





