Introdução
O metotrexato (MTX) é um fármaco extensamente utilizado como imunossupressor no âmbito das doenças autoimunes, especialmente na artrite reumatóide (AR), onde é agente de primeira linha(1). É um antimetabolito do folato, atuando como inibidor competitivo da dihidrofolato redutase e inibindo a síntese e reparação do DNA e a replicação celular(2, 3).
Os efeitos adversos do MTX são relativamente frequentes mas, nas doses habitualmente utilizadas para o tratamento da AR, são geralmente pouco graves, sendo os mais comuns os gastrointestinais, hepáticos, pulmonares, hematológicos e infeciosos(2).
A leucoencefalopatia é uma complicação bem documentada do MTX administrado por via intravenosa ou intratecal em doses altas, sendo muito mais raramente descrita em relação com terapêutica prolongada com doses baixas administradas por via oral(3, 4). Uma vez que a molécula atravessa mal a barreira hematoencefálica (BHE), a neurotoxicidade associada à administração oral é geralmente ligeira (alterações do humor, tonturas e cefaleias)(3, 5).
Caso Clínico
Apresentamos o caso de uma mulher de 72 anos, com antecedentes de linfocitose granular crónica do sangue periférico, sem clínica sugestiva de progressão para leucemia (neutropenia, infeções de repetição, sintomas B ou hepatosplenomegalia) e com uveíte posterior crónica idiopática do olho esquerdo sob corticóide oral.
A doente apresentava poliartralgias com anos de evolução, de carácter sobretudo mecânico, mas para as quais tinha sido previamente assumido o diagnóstico de AR. Neste contexto, foi tratada durante cerca de 8 anos com MTX oral em baixa dose (10 mg/semana, dose cumulativa exata desconhecida); manteve o tratamento até cerca de 1 mês depois da instalação do quadro atual, altura em que foi suspenso por se ter reavaliado o diagnóstico e se ter concluído que não cumpria critérios de AR.
Desenvolveu um quadro rapidamente progressivo (com cerca de 2 meses de evolução) de alterações da marcha, com base alargada, pequenos passos e quedas frequentes, e de deterioração cognitiva e de memória, com apatia, períodos de confusão, desorientação temporal e discurso mais pobre, tendo recorrido ao Serviço de Urgência e sido admitida para estudo em regime de internamento. Ao exame objetivo destacava-se uma marcha instável, de base alargada, associada a ligeira flexão anterior do tronco e passos curtos, sem outras alterações relevantes.
Durante o internamento evoluiu com degradação rápida do estado neurológico com perda completa da capacidade de marcha, discurso praticamente inexistente e dificuldade no cumprimento de ordens, com aparente apraxia da deglutição. Encontrava-se nesta fase vígil, tentando comunicar, sendo notório o envolvimento do sistema piramidal e extrapiramidal, assim como compromisso cognitivo e cerebeloso (movimentos oculares com intrusões sacádicas, hipofonia marcada, tetraparésia espástica com predomínio nos membros inferiores, reflexo cutâneo-plantar extensor à esquerda, atrofia dos interósseos das mãos, inclinação do tronco com distonia cervical, mioclonias dispersas, centro-faciais e dos membros e grave instabilidade postural). Apresentava reflexos osteotendinosos vivos simétricos, não colaborando no restante exame nomeadamente na pesquisa de bradicinesia ou nas provas cerebelosas.Continuou a deteriorar paulatinamente ao longo do internamento.
Do ponto de vista de estudo etiológico, realizou tomografia computorizada (TC) e ressonância magnética (RM) cerebrais que excluíram a presença de lesões ocupantes de espaço, mas mostraram sinais de extensa leucoencefalopatia (Fig. 1); não apresentava alterações metabólicas que justificassem o quadro, a serologia de vírus de imunodeficiência humana foi negativa e o estudo imunológico com anticorpos antinucleares, anti-dsDNA, anti-SSA, antifosfolípido e anticitoplasma do neutrófilo foi negativo, com fator reumatóide apenas marginalmente positivo e anti-peptídeos citrulinados negativos. Realizada punção lombar (PL) que mostrou 3 células/µL, com a citologia a revelar linfócitos sem atipia nuclear e histiócitos no líquido cefalorraquidiano (LCR), com presença de algumas células degeneradas, sugestivo de lesão inflamatória/reativa, sem alterações da proteinorráquia ou da glicorráquia; a imunofenotipagem de LCR não apresentou alterações e foi descartada ainda patologia infeciosa bacteriana (bacteriológico, micobacteriológico com pesquisa de PCR paraMycobacterium tuberculosis, serologia deBorreliae VDRL negativos). Fez TC toraco-abdomino-pélvico, sem evidência de massas ou lesões suspeitas de malignidade, ecografia mamária e tiroideia normais e observação por Ginecologia sem alterações, pelo que se afastou causa neoplásica/paraneoplásica como etiologia do quadro.
O eletroencefalograma revelou atividade difusamente lenta de 6-7 Hz, compatível com encefalopatia, sem achados específicos ou focalizadores; uma nova RM cerebral mostrou agravamento da leucoencefalopatia (Fig. 2). Repetiu PL, novamente com citologia negativa para células malignas, imunofenotipagem negativa e pesquisa de vírus JC,Tropheryma whippleie proteína 14.3.3 negativas. Foram consideradas como hipóteses diagnósticas mais prováveis a encefalite autoimune, vasculite primária do sistema nervoso central (SNC) ou o linfoma do SNC. Iniciou neste momento pulsos de metilprednisolona (1 g/dia durante 5 dias), sem melhoria clínica.
Foi avaliada por Oftalmologia, mantinha vitrite, com vítreo bastante denso e múltiplos focos de coroidite multifocal; realizada biópsia do vítreo, com microbiológico negativo e citologia com numerosos linfócitos CD3+e CD20-.
Desenvolveu múltiplas intercorrências infeciosas que foram tratadas com antibioterapia de largo espectro, mas que culminaram na morte da doente ao fim de 3 meses de internamento, altura em que se encontrava acamada, totalmente dependente e sem vida de relação. Solicitámos autópsia anátomo-clínica, que revelou pneumonia como causa de morte, e o cérebro foi enviado para o Portuguese Brain Bank.
O exame neuropatológico do cérebro revelou lesões de substância branca difusas e coalescentes ao nível occipital e temporal superior, correspondendo a mielinólise extensa da substância branca subcortical, com infiltrados perivasculares de predomínio macrofágico, perda neuronal e astrogliose. Observavam-se ainda lesões ao nível dos gânglios da base, particularmente ao nível do globo pálido, e cerebelo, com perda neuronal, astrocitose severa e pequenos infiltrados inflamatórios perivasculares (Fig.3). O diagnóstico neuropatológico foi de encefalopatia com extensa mielinólise, com envolvimento dos gânglios da base e cerebelo. No contexto clínico da doente e na ausência de achados que suportem causas inflamatórias, infeciosas, neoplásicas ou degenerativas alternativas, estes resultados são compatíveis com leucoencefalopatia induzida pelo metotrexato.
Discussão
O motivo pelo qual uma molécula que penetra mal no SNC pode causar efeitos tão dramáticos a nível da substância branca quando administrada por via oral ainda não está bem definido. Alguns autores sugerem como mecanismos de neurotoxicidade a lesão direta(4), lesão inflamatória da BHE(5), ou acumulação de substâncias como a adenosina e a homocisteína(3, 6); em alguns doentes foram descritas mutações em enzimas relacionadas com o metabolismo do folato, nomeadamente a metilenotetrahidrofolato redutase (MTHFR)(3, 7). Particularmente no caso do tratamento oral a duração do tratamento e a dose cumulativa parecem desempenhar papéis importantes(3, 8).
O tratamento desta entidade baseia-se essencialmente na suspensão precoce do fármaco e no suporte; a corticoterapia e a suplementação com ácido fólico foram também tratamentos descritos em alguns casos clínicos(3, 9, 10). Apesar da suspensão do fármaco, o outcome é variável, desde a lesão ligeira e reversível até lesões graves irreversíveis ou mesmo fatais, como a leucoencefalopatia necrotizante disseminada e a mielinólise maciça(3, 7-14).
Os achados patológicos estão pouco descritos e são relativamente inespecíficos; na neurotoxicidade do MTX oral estão descritos desmielinização extensa, agregados macrofágicos e infiltrados perivasculares, com alterações fibrinóides da túnica íntima dos capilares(10, 14).
A nossa doente apresentava um quadro clínico, imagiológico e histopatológico compatível com leucoencefalopatia induzida pelo MTX; as etiologias alternativas foram excluídas pela extensa investigação realizada. A suspensão do fármaco, já após o início dos sintomas, mas antes da admissão hospitalar, não impediu, neste caso, a progressão inexorável da doença, apesar de ter realizado tratamento com doses elevadas de corticóide.
Os autores pretendem alertar para esta entidade rara, que deve figurar no diagnóstico diferencial de leucoencefalopatia em doentes tratados com MTX, ainda que em dose baixa e administrado por via oral.
Agradecimentos
Dr. José Alves, Serviço de Neurorradiologia, Centro Hospitalar do Porto, Porto, Portugal
Apresentações prévias
Caso clínico apresentado previamente como poster no 17º Congresso Europeu de Medicina Interna.
Figura I
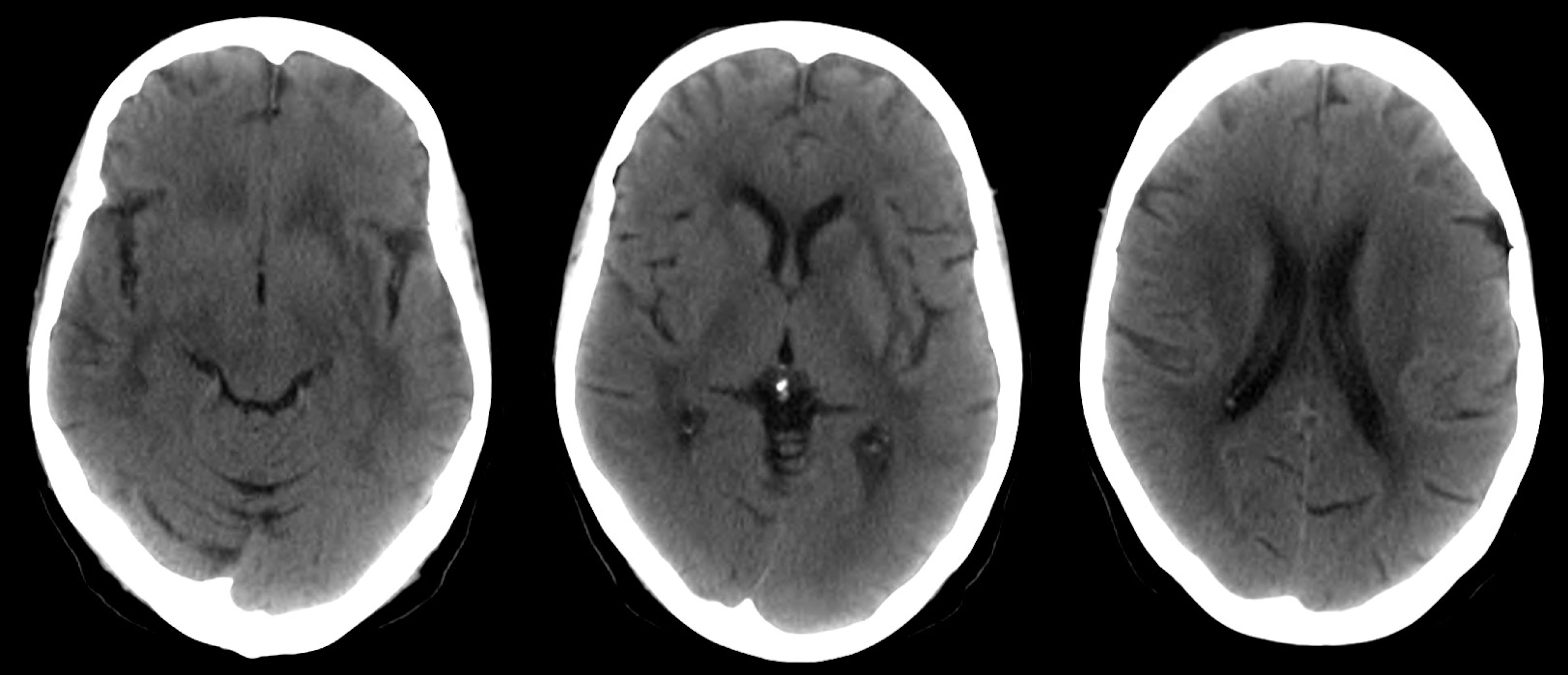
Imagens da tomografia computorizada (TC) cerebral. Nesta TC inicial podemos observar acentuação da hipodensidade da substância branca periventricular a traduzir extensa leucoencefalopatia confluente.
Figura II
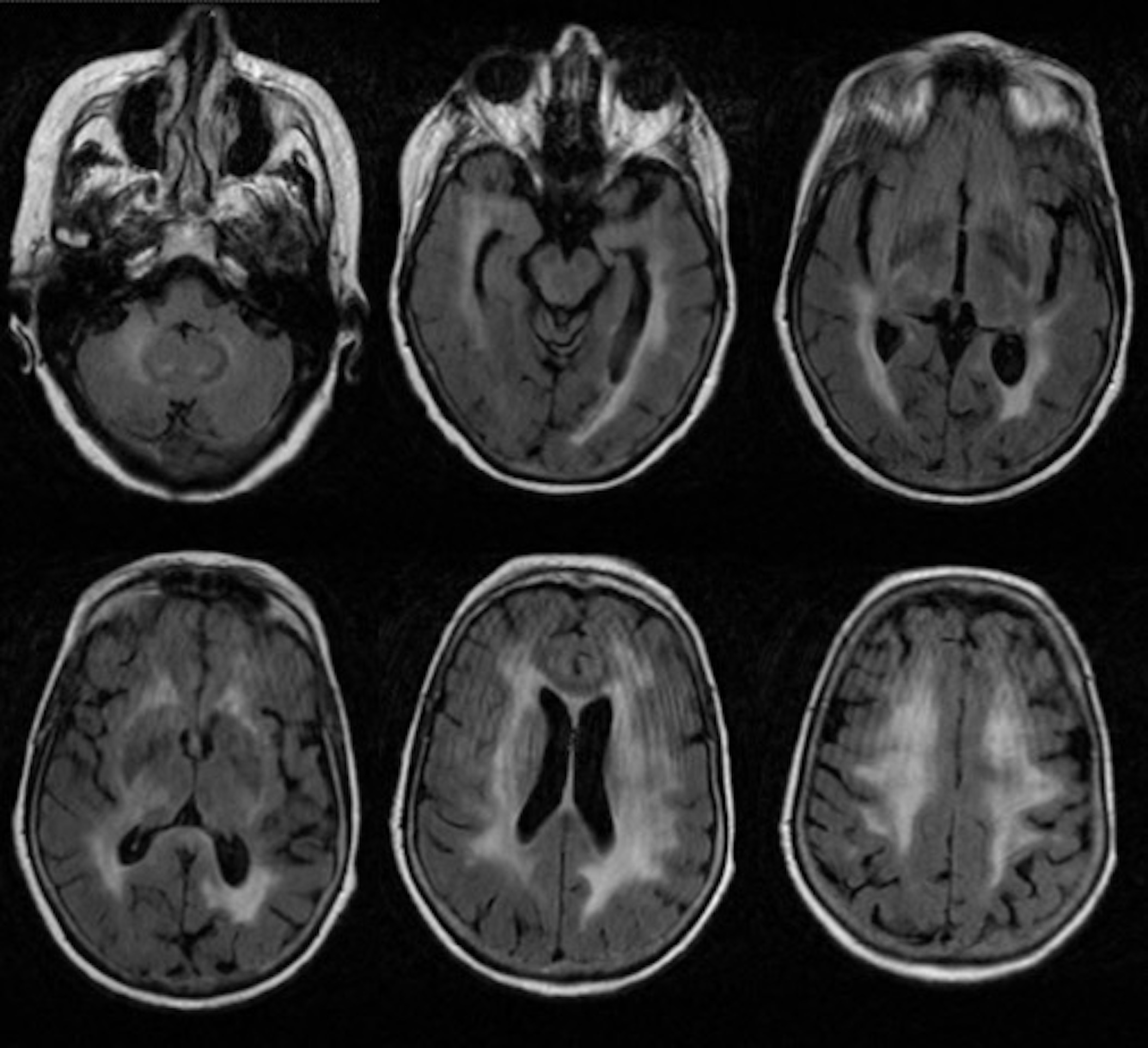
Imagens de ressonância magnética cerebral com ponderação em T2 FLAIR (fluid attenuated inversion recovery); imagens com algum artefacto de movimento. Neste estudo de imagem, obtido após agravamento clínico, observam-se exuberantes áreas de hipersinal a envolver de forma difusa a substância branca periventricular supratentorial, tálamos, regiões núcleo-capsulares, coroas radiadas e centros semiovais, atingindo também os pedúnculos cerebelosos médios e porção superior dos hemisférios cerebelosos de predomínio direito, sugerindo lesão extensa da substância branca encefálica.
Figura III
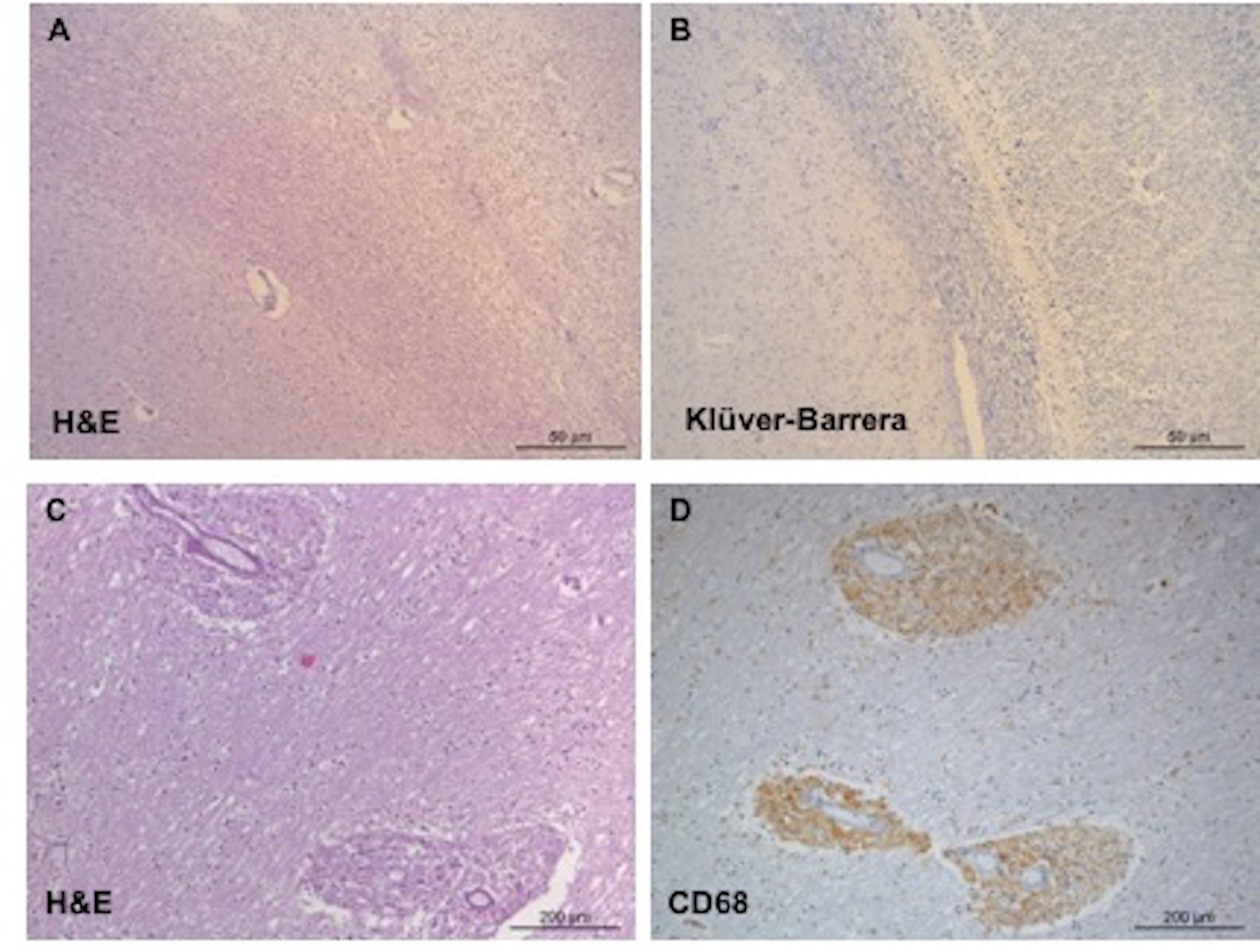
Exemplos representativos do estudo neuropatológico. Mielinólise da substância branca subcortical da região occipital (A e B); infiltrados inflamatórios de predomínio macrofágico (CD68+) no cíngulo (C e D).
BIBLIOGRAFIA
1. Smolen JS, Landewé R, Bijlsma J, Burmester G, Chatzidionysiou K, Dougados M, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2016 update. Annals of the Rheumatic Diseases. 2017;76(6):960.
2. Wang W, Zhou H, Liu L. Side effects of methotrexate therapy for rheumatoid arthritis: A systematic review. European Journal of Medicinal Chemistry. 2018;158:502-16.
3. González-Suárez I, Aguilar-Amat M, Trigueros M, Borobia A, Cruz A, Arpa J. Leukoencephalopathy due to Oral Methotrexate. Cerebellum. 2014;13(1):178-83.
4. Filley CM, Kleinschmidt-DeMasters BK. Toxic Leukoencephalopathy. New England Journal of Medicine. 2001;345(6):425-32.
5. Matsuda M, Kishida D, Kinoshita T, Hineno A, Shimojima Y, Fukushima K, et al. Leukoencephalopathy Induced by Low-dose Methotrexate in a Patient with Rheumatoid Arthritis. Internal Medicine. 2011;50(19):2219-22.
6. Paudyal B, Viets R, Skliut M. A Case of Low-Dose Oral Methotrexate–Induced Reversible Neurotoxicity. American Journal of Neuroradiology. 2010;31(9):E77.
7. Limaye K, Patel A, Bianchi N, Hinduja A. A twisted tale of PRES. Acta Neurol Belg. 2015;115(2):187–9.
8. Hart C, Kinney MO, McCarron MO. Posterior reversible encephalopathy syndrome and oral methotrexate. Clinical Neurology and Neurosurgery. 2012;114(6):725-7.
9. Koppen H, Wessels JA, Ewals JAPM, Treurniet FEE. Reversible Leukoencephalopathy After Oral Methotrexate. The Journal of Rheumatology. 2012;39(9):1906.
10. Raghavendra S, Nair MD, Chemmanam T, Krishnamoorthy T, Radhakrishnan VV, Kuruvilla A. Disseminated necrotizing leukoencephalopathy following low-dose oral methotrexate. European Journal of Neurology. 2007;14(3):309-14.
11. Worthley S, McNeil J. Leukoencephalopathy in a patient taking low dose oral
methotrexate therapy for rheumatoid arthritis. J Rheumatol. 1995;22(2):335-7.
12. Marcon G, Giovagnoli AR, Mangiapane P, Erbetta A, Tagliavini F, Girotti F. Regression of chronic posterior leukoencephalopathy after stop of methotrexate treatment. Neurol Sci. 2009;30(5):375–8.
13. Renard D, Westhovens R, Vandenbussche E, Vandenberghe R. Reversible posterior leucoencephalopathy during oral treatment with methotrexate. J Neurol. 2004;251(2):226–8.
14. Yokoo H, Nakazato Y, Harigaya Y, Sasaki N, Igeta Y, Itoh H. Massive myelinolytic leukoencephalopathy in a patient medicated with low-dose oral methotrexate for rheumatoid arthritis: an autopsy report. Acta Neuropathol. 2007;4(4):425–30.




