INTRODUÇÃO
A doença de Whipple (DW) é uma doença infeciosa bacteriana extremamente rara, que se caracteriza tipicamente pela sua abrangência multissistémica. O agente patogénico - Thopheryma Whipplei (TW) - ubiquitário no ambiente, é um bacilo com positividade para o gram e ácido periódico de schiff (PAS), de crescimento lento e baixa patogenicidade.1 Apesar das primeiras descrições relativas a esta entidade se reportarem a 1907, só em 1991 este agente foi identificado.2
Oespectro clínico da DW é amplo, sendo alvo de recentes revisões. São reconhecidas 4 formas: (i) portador assintomático; (ii) infeção aguda e auto-limitada (p. ex. gastroenterite, pneumonia ou bacteriemia); (iii) infeção localizada crónica - mais frequentemente endocardite com exame cultural negativo. Pode ainda ser identificado o envolvimento isolado do sistema nervoso central (encefalite), pulmonar (doença do interstício, hipertensão pulmonar), linfático (geralmente, adenopatias mesentéricas), do olho (uveíte) ou osteo-articular (sinovite); (iv) DW clássica – com envolvimento multi-sistémico e evolução insidiosa, caracteriza-se por quatro sintomas cardinais: artralgias, perda ponderal, diarreia e dor abdominal (nem sempre presentes sincronamente ao diagnóstico).3 Alguns autores consideram uma última classificação, a DW associada a imunossupressão, sendo nestes casos a disrupção do delicado balanço da homeostasia imunológica o principal fator determinante para as manifestações clínicas e da busca diagnóstica.1
Apesar da sua evolução insidiosa, caso não tratada a DW é potencialmente fatal.
CASO CLÍNICO
Homem, 61 anos, caucasiano, reformado (construção civil). Ex-emigrante em França, onde era seguido e medicado por reumatologista com metotrexato (15mg por semana) e corticoterapia oral (prednisolona 5mg/dia) desde há 4 anos, por artralgias migratórias das grandes articulações (ombros, joelhos e tornozelos), sem artrite. Ex-fumador (50 UMA). Medicado ainda com ácido fólico, omeprazol e anti-inflamatório não esteroides em SOS.
Em Julho de 2015, recorre ao serviço de urgência por dispneia de esforço progressiva, ortopneia, tosse seca, astenia, anorexia e perda ponderal (8kg) com um mês de evolução. Referia nos últimos 15 dias, epigastralgia de moderada intensidade, constante, sem fatores de alívio ou agravamento. Negadas alterações do trânsito intestinal.
Ao exame objetivo consciente, colaborante e orientado. Emagrecido e pálido. Sem sinais de dificuldade respiratória ou cianose, apresentava saturação periférica em ar ambiente de 89%, com diminuição dos sons respiratórios e das transmissões vocais na metade inferior do hemitórax direito e crepitações na base esquerda. Normotenso e apirético. Abdómen mole e depressível, indolor, sem organomegalias ou adenomegalias palpáveis. Presença de hipocratismo digital. Sem sinais inflamatórios articulares ou edema periférico.
Analiticamente (Quadro 1), anemia normocítica/normocrómica que se revelou ferropénica, VS elevada e hipoxemia (gasometria sem oxigénio suplementar: pO2 57mmHg; saturação de oxigénio 92%). Radiografia torácica com derrame pleural à direita (Figura 1-A). TC torácico mostrou derrame pleural bilateral (moderado volume à direita e pequeno volume à esquerda), áreas em“vidro despolido“ e áreas dispersas de“air-trapping“ (Figura 2). Toracocentese diagnóstica revelou um exsudado, com predomínio de células mononucleares (Quadro 2).
Admitido a internamento para continuação de estudo etiológico; foi suspensa imunossupressão.
Apresentou pico febril único ao 6º dia de internamento. Estudos microbiológicos (bacteriológico de secreções brônquicas e líquido pleural, micobacteriológico de secreções brônquicas e hemoculturas), virológico (VIH, VHB e VHC) e imunológico (ANA e ANCA) negativos.
Documentado hipoproteinémia, hipoalbuminémia, valores baixos de colesterol e triglicerídeos e agravamento progressivo da anemia (Quadro 1).
Endoscopia digestiva alta (Figura 3) documentou duodenopatia congestiva (realizadas biópsias). Ecocardiograma transtorácico com sinais de hipertensão pulmonar – HTP [pressão sistólica da artéria pulmonar (PSAP) de 50mmHg + pressão venosa central (pVC)] e perturbação marcada do septo interventricular. Foi excluído tromboembolismo pulmonar por angio-TC. Resultado anatomo-patológico de biópsia duodenal: dilatação das vilosidades por acumulação maciça de macrófagos com conteúdo PAS-positivo, compatível com Doença de Whipple (Figura 4); diagnóstico confirmado por PCR. Iniciado tratamento com ceftriaxone 2g id, 14 dias, sendo programado tratamento em ambulatório com trimetoprim-sulfametoxazol (TMP-SMX) 960mg bid por 12 meses e suplementação de ferro oral. Em reavaliação em ambulatório, o doente apresentou melhoria clínica progressiva, com recuperação ponderal progressiva. Analiticamente, resolução da anemia e défices identificados (Quadro 1) e melhoria imagiológica do derrame pleural (Figura 1-B). A reavaliação ecocardiográfica revelou reversão dos critérios de hipertensão pulmonar (PSAP estimada de 21 mmHg + pVC) e, ausência da perturbação do septo interventricular. Repetida biópsia duodenal após um ano de tratamento que confirmou a erradicação da bactéria.
DISCUSSÃO
O TW é um agente ubiquitário no ambiente e a invasão e “incorporação” do bacilo pode ocorrer em diferentes tecidos/elementos celulares, após contacto com fezes ou saliva de doentes ou portadores do TW. Em adição, o organismo apresenta fraca resposta citotóxica às células hospedeiras, permitindo a acumulação maciça do agente.4,5 As manifestações clínicas não parecem determinadas por fatores inerentes ao agente mas por uma deficiência imune do hospedeiro, estando descritas o início das mesmas com terapêutica imunossupressora, tal como o caso apresentado.
Neste doente ressalta-se o envolvimento de vários sistemas:
- Osteo-articular: geralmente é o primeiro sistema envolvido, podendo preceder a sintomatologia gastrointestinal em até 6 anos.6 Embora não seja descrito na literatura um padrão clássico de apresentação, o envolvimento articular manifesta-se tipicamente por artralgias migratórias das grandes articulações (sobretudo as periféricas – joelho, punho, tornozelo). Pode ainda manifestar-se por oligo ou poliartrite migratória crónica, sendo que a destruição/deformação articular é rara.7,8 Neste caso, apesar do início de terapêutica imunossupressora na presunção de artropatia sero-negativa, o doente manteve artralgias migratórias persistentes, sem documentação de derrame articular associado.
- Gastrointestinal: Até 15% dos casos podem não apresentam manifestações gastrointestinais, dificultando a persecução deste diagnóstico.9 O envolvimento deste sistema, geralmente surge tardiamente no curso da doença e caracteriza-se por episódios recorrentes de diarreia aquosa/esteatorreia e dor abdominal. A sua progressão leva à instalação de um síndrome de má absorção, com perda ponderal e, em casos mais graves, ascite.4,10 No caso apresentado foram documentados défices sugestivos de má absorção (ferropenia, hipoalbuminemia, hipotrigliceridemia e hipocolesterolemia) o que impulsionaram à realização de endoscopia digestiva alta com biópsias duodenais, exame crucial para estabelecer o diagnóstico.
- Pulmonar/cardiovascular: Embora o envolvimento pulmonar esteja descrito em algumas séries em cerca de 13% dos casos9 – com derrame pleural, tosse crónica, pneumonia ou tipo doença intersticial pulmonar - o que reforça a raridade deste caso é a apresentação com HTP. A associação da DW com esta manifestação cardiovascular envolvendo a circulação pulmonar é extremamente rara, com casos pontuais descritos na literatura. Em 9 casos relatados na base dados Pubmed® e tal como o caso apresentado, a principal evidência da relação da DW com a HTP é a resolução após tratamento antibiótico. A base fisiopatológica desta manifestação permanece por esclarecer, sendo a invasão e espessamento das arteríolas pulmonares pelos macrófagos PAS-positivo e detritos fibrinóides, com obliteração luminal parcial, a principal hipótese postulada.11
Previamente à disponibilidade de antibioterapia, a DW era invariavelmente fatal. O esquema terapêutico recomendado, baseia-se no sucesso de pequenos estudos observacionais, sendo indicada uma fase inicial de terapêutica endovenosa com ceftriaxone ou penicilina, seguida de uma fase de manutenção de 12 meses sob TMP-SMX ou, alternativamente, doxiciclina associada a hidroxicloroquina.12,13 A duração da fase inicial é dependente da manifestação clínica preconizando-se geralmente 2 semanas de tratamento, prolongado para 4 semanas no caso do envolvimento cardíaco com endocardite (alguns autores recomendam este prolongamento também no envolvimento do sistema nervoso central embora não esteja demonstrado impacto prognóstico). Apesar da eficácia demonstrada do esquema com TMP-SMX, foram documentadas resistências in vitro a este agente, com os efeitos adversos conhecidos a persistirem como foco de preocupação. Assim, a literatura Europeia mais recente sugere um esquema baseado na associação doxiciclina-hidroxicloroquina, o único tratamento bactericida in vitro.13
Após início terapêutico prevê-se uma melhoria clinica em escassas semanas, com a vigilância posterior sendo fundamental para assegurar o sucesso terapêutico e diagnosticar precocemente recidiva. Não existem recomendações específicas na monitorização da doença, recomendando-se geralmente a repetição da pesquisa em biópsia duodenal e, em casos de envolvimento do sistema nervoso central, no líquido cefalo-raquidiano. 13
CONCLUSÃO
Em consonância com o descrito na literatura, a abrangência multissistémica da DW (justificando o facto de ser considerada uma mimetizadora de diversas doenças) e a sua raridade (incidência inferior a 1/1.000.000 habitantes) sublimam o desafio diagnóstico que representa.14 Ressalva-se a ausência de envolvimento de outros sistemas, nomeadamente, o cutâneo e o facto de não ter sido excluído o envolvimento do sistema nervoso central cuja investigação é recomendada por alguns autores, mesmo na ausência de sinais/sintomas, dado se tratar da forma de doença potencialmente mais incapacitante.10
Assim, a DW implica uma alto índice de suspeição clinica, devendo ser considerada na presença dos 4 sintomas cardinais (artralgias, diarreia, perda ponderal e dor abdominal), após excluídas as etiologias mais comuns e, em particular, perante uma poliartrite migratória com negatividade para o factor reumatóide, sem resposta a imunossupressão. Entre as várias manifestações possíveis e observadas no caso apresentado, destaca-se a hipertensão pulmonar, documentada na literatura em raros casos de DW e cuja fisiopatologia permanece obscura. A resolução completa desta manifestação após antibioterapia é a evidência mais forte para uma relação causal.
Figura I
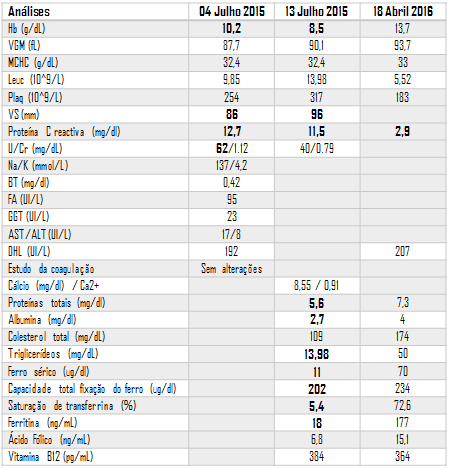
Quadro 1. Evolução dos resultados laboratoriais ao longo do seguimento do doente
Figura II
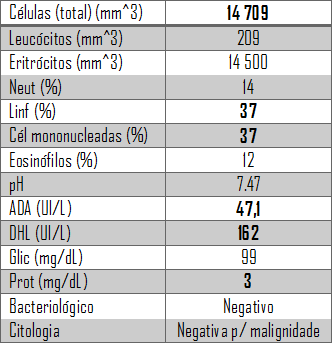
Quadro 2. Resultados laboratoriais da toracocentese diagnóstica
Figura III
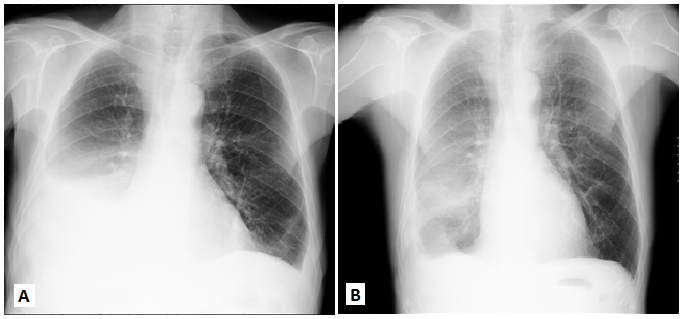
Figura 1. Radiografia torácica na admissão (A) e reavaliação após terapêutica (B)
Figura IV
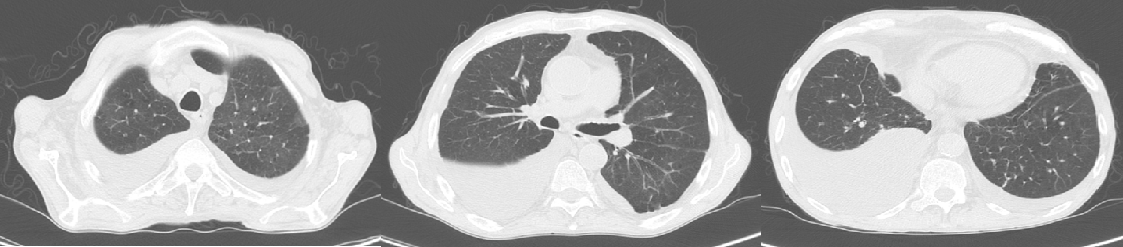
Figura 2. TC torácica - Avaliação inicial
Figura V
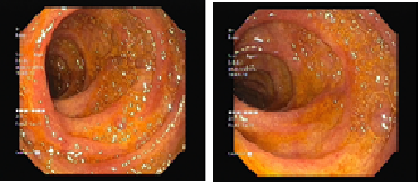
Figura 3. Mucosa duodenal
Figura VI
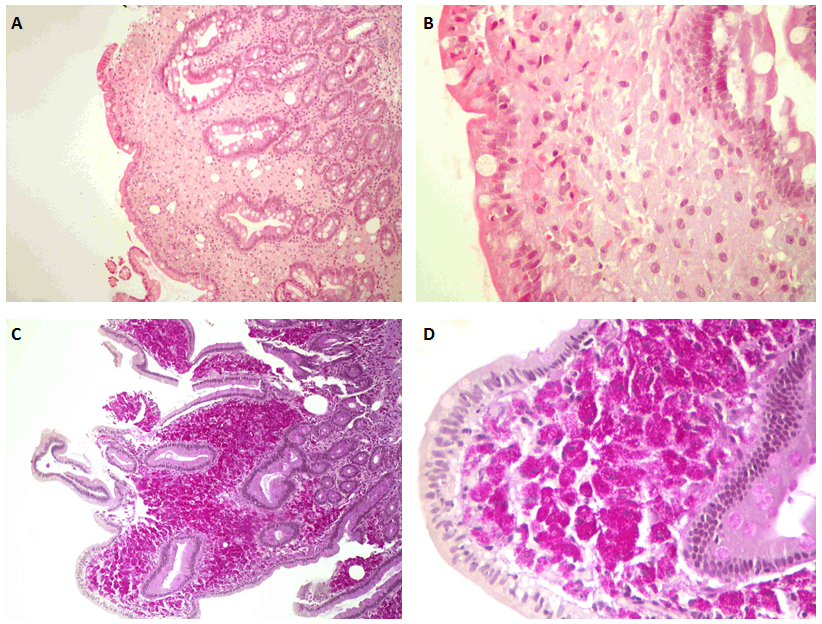
Figura 4. A e B - (H-E, 10x e 40x) Mucosa duodenal com células granulares no córion; C e D - (PAS 4x e 40x) Material PAS positivo, diastase resistente, no citoplasma dos macrófagos.
BIBLIOGRAFIA
(1) Marth, T. Systematic review: Whipple´s disease (Tropheryma whipplei infection) and its unmasking by tumour necrosis factor inhibitors. Aliment Pharmacol Ther. 2015; 41(8): 709-724. DOI: 10.1111/apt.13140
(2) Dolmans RA, Boel CH, Lacle MM, Kusters JG. Clinical Manifestations, Treatment, and Diagnosis of Tropheryma whipplei Infections. Clin Microbiol Rev. 2017;30(2):529–555. DOI: 10.1128/CMR.00033-16
(3) Fenollar F, Lagier J-C, Raoult D. Tropheryma whipplei and Whipple’s disease. J Infect 2014; 69(2):103–12. DOI: 10.1016/j.jinf.2014.05.008.
(4) Marth T, Moos V, Müller C, Biagi F, Schneider T. Tropheryma whipplei infection and Whipple’s disease. Lancet Infect Dis. 2016; 16 (3): e13–22. DOI: 10.1016/S1473-3099(15)00537-X
(5) Bentley S-D, Maiwald M, Murphy L-D, Pallen M-J, Yeats C-A, Dover L-G, et al. Sequencing and analysis of the genome of the Whipple´s disease bacterium Tropheryma whipplei. Lancet. 2003; 361, 637–644. DOI: 10.1016/S0140-6736(03)12597-4
(6) Glaser C, Rieg S, Wiech T, Scholz C, Endres D, Stich O, et al. Whipple´s disease mimicking rheumatoid arthritis can cause misdiagnosis and treatment failure. Orphanet J Rare Dis. 2017; 12(1):99. DOI: 10.1186/s13023-017-0630-4
(7) Moos V, Schneider T. Changing paradigms in Whipple´s disease and infection with Tropheryma whipplei. Eur J Clin Microbiol Infect Dis. 2011; 30:1151. DOI: 10.1007/s10096-011-1209-y
(8) Lagier JC, Lepidi H, Raoult D, Fenollar F. Systemic Tropheryma whipplei: clinical presentation of 142 patients with infections diagnosed or confirmed in a reference center. Medicine (Baltimore) 2010; 89:337. DOI: 10.1097/MD.0b013e3181f204a8
(9) Durand DV, Lecomte C, Cathebras P, Rousset H, Godeau P. Whipple disease. Clinical review of 52 cases. The SNFMI research group on whipple disease. Societe nationale francaise de medecine interne. Medicine (Baltimore). 1997; 76(3):170–184. DOI: 10.1097/00005792-199705000-00003
(10) Günther U, Moos V, Offenmüller G, Oelkers G, Heise W, Moter A, et al. Gastrointestinal diagnosis of classical Whipple disease: clinical, endoscopic, and histopathologic features in 191 patients. Medicine (Baltimore) 2015; 94:e714. DOI: 10.1097/MD.0000000000000714
(11) Baloira A, Nunez M, Tumbeiro M, Parente-Lamelas I, Bastos M, Gutierrez M. Pulmonary hypertension associated with Whipple disease. Eur Respir Rev. 2014. 23:533–536. DOI: 10.1183/09059180.00005714.
(12) El-Abassi R, Soliman MY, Williams F, England JD. Whipple’s disease. J Neurol Sci. 2017; 377:197–206. DOI: 10.1016/j.jns.2017.01.048
(13) Hujoel IA, Johnson DH, Lebwohl B, Leffler D, Kupfer S, Wu T-T , et al. Tropheryma whipplei infection (Whipple Disease) in the USA. Dig Dis Sci. 2019. 64: 213. DOI: 10.1007/s10620-018-5033-4
(14) Fenollar F, Puéchal X, Raoult D. Whipple’s Disease. N Engl J Med. 2007; 356:55–66. DOI: 10.1056/NEJMra062477







