INTRODUÇÃO:
O mieloma múltiplo é caracterizado pela proliferação neoplásica de plasmócitos produzindo uma imunoglobulina monoclonal, correspondendo a 1-2% de todas as neoplasias e cerca de 17% das neoplasias hematológicas, sendo 2-3 vezes mais frequente em indivíduos de raça negra, discretamente mais comum em homens e com uma idade média de diagnóstico de 66 anos.1 É caracterizado por lesão de órgão-alvo, que inclui hipercalcémia, disfunção renal, anemia e/ou lesões ósseas líticas.1 A doença renal nestes doentes resulta da produção de imunoglobulina monoclonal, que vai condicionar a formação de cilindros intratubulares, toxicidade tubular directa e/ou deposição de cadeias leves e pesadas2; a gravidade da doença renal é um factor independente de prognóstico.3,4 A hipercalcémia no mieloma múltiplo está relacionada com a libertação de factores activadores dos osteoclastos pelas células tumorais. A alta taxa de reabsorção óssea associada à ausência de formação de osso mediada pelos osteoblastos resulta numa perda difusa de massa óssea.5, 6
Em 1-4% de todos os casos de mieloma múltiplo existe progressão de doença na forma de leucemia a plasmócitos secundária. No entanto, 60-70% dos casos de leucemia a plasmócitos ocorrem como manifestação inicial da doença, em média cerca de uma década mais cedo (55 vs 65 anos). 8
CASO CLÍNICO:
Apresentamos o caso de um homem de 75 anos, autónomo nas actividades de vida diária. Tratava-se de doente com história de hipertrofia benigna da próstata, medicado com silodosina; episódio de trauma com fractura de vértebras dorsais no passado, sem intervenção cirúrgica. Sem outros antecedentes pessoais nem história familiar relevantes. Sem hábitos tabágicos ou etanólicos, nem alergias medicamentosas conhecidas.
Estava a ser estudado em ambulatório face a quadro de astenia, anorexia e perda ponderal de 12kg (16% do peso corporal) progressivas nos últimos 6 meses. Negava qualquer outro sintoma, como febre, sudorese nocturna, tosse, sintomas urinários, dispepsia, dor abdominal, alteração do trânsito intestinal ou perdas hemáticas. Já havia sido realizado vários exames complementares de diagnóstico, nomeadamente ecografias prostática, renal, vesical e tiroideia, colonoscopia, endoscopia digestiva alta e TC toracoabdominopelvica, todos eles sem alterações de relevo.
O doente foi então encaminhado ao Serviço de Urgência pela sua médica assistente por agravamento franco da função renal nas últimas 3 semanas (ureia 64>122mg/dl e creatinina 1,33>5,03mg/dl) e hipercalcémia (10,68>13,69mg/dl). Neste mesmo período, foi sentido agravamento da sintomatologia, bem como aparecimento de dorsalgia de características mecânicas.
À observação na admissão, doente vigil, orientado e colaborante; temperatura timpânica 36,4ºC, pressão arterial 155/81mmHg, frequência cardíaca 65bpm, eupneico em ar ambiente (saturação periférica de oxigénio de 97%). Pele e mucosas descoradas e desidratadas, acianóticas e anictéricas. Sons cardíacos rítmicos, sem sopros ou extrassons. Murmúrio vesicular mantido e simétrico, sem ruídos adventícios. Abdómen: ruídos hidro-aéreos mantidos; mole, depressível e indolor; sem massas ou organomegálias palpáveis. Sem edema periférico. Dor à palpação das apófises espinhosas dorsais.
Realizados exames complementares diagnósticos, como:
- Analiticamente com anemia normocítica normocrómica, leucocitose, lesão renal aguda, hiponatrémia, hipercalcémia, hiperfosfatémia e hipoalbuminémia (Tabela 1);
- Gasimetria arterial em ar ambiente com discreta alcalémia metabólica e hipercalcémia (Tabela 1);
- Urina II com proteínas ++, leucócitos ++, hemoglobina ++; urocultura negativa;
- Electrocardiograma em ritmo sinusal, com bloqueio de ramo direito já conhecido;
- Radiografia torácica com reforço hilar à direita e cisurite à direita;
- Ecografia renal e vesical com rins em topografia habitual, normodimensionados e simétricos, espessura parenquimatosa conservada e diferenciação parênquimo-sinusal preservada bilateralmente; sem sinais de uretero-hidronefrose bilateralmente, nem líquido peri-renal; escassos quistos renais simples bilaterais; bexiga em ligeira repleção com conteúdo puro; sem ascite nos recessos pélvicos.
Do estudo adicional realizado, salienta-se:
- Analiticamente (Tabela 2): esfregaço de sangue periférico com linfoplasmócitos, alguns plasmócitos (não quantificados) e rouleaux eritrocitários, β2-microglobulina e ácido úrico elevados e hipoparatiroidismo; serologias negativas para VIH, hepatite B e C; proteinograma (Figura 1) com identificação de pico monoclonal na região gama - 7,6g/dl;
- Radiografias do crânio sem evidência de lesões líticas e da coluna vertebral com afundamento de 2 corpos vertebrais (relacionadas com traumatismo no passado);
- Ecografia abdominal que evidenciou fígado e baço normodimensionados, com ecoestrutura homogénea, sem lesões focais; vesícula biliar em moderada repleção, de parede não espessada e sem litíase; vias biliares não ectasiadas; favorável apreciação dos segmentos pancreáticos visualizados (região cefálica e corpo); ausência de líquido ascítico nos diferentes recessos peritoneais; rins normodimensionados e com normal espessura parenquimatosa e diferenciação parenquimo-sinusal mantida; quistos corticais renais simples bilateralmente (o maior no pólo inferior do rim esquerdo com 3cm); sem ectasia das árvores excretoras nem alterações peri-renais.
- Imunofixação sérica a confirmar gamapatia monoclonal IgG/lambda, com doseamento de IgG 9856mg/dl e presença de proteinúria de Bence-Jones lambda/lambda livre;
- Mielograma com evidência de medula hipercelular com infiltração por 96% de plasmócitos maduros, raros binucleados, com raros elementos residuais das restantes células hematopoiéticas; depósitos extra-eritroblásticos de hemossiderina aumentados (++++--), sem sideroblastos; identificados ainda 21%(3040/µl)de plasmócitos no sangue periférico, compatível com o diagnóstico de leucemia a plasmócitos.
DISCUSSÃO:
A leucemia a plasmócitos é uma forma rara, mas agressiva de mieloma múltiplo, caracterizada por níveis elevados de plasmócitos circulantes no sangue periférico (2000/µl ou 20% do total de leucócitos) (7,8). Na Europa, tem uma incidência de apenas 4 casos por 10.000.000 de pessoas por ano, logo devido à baixa incidência e prevalência desta entidade, a maior parte dos dados clínicos provém de pequenas séries de casos. Sabe-se que tem uma idade média de apresentação entre os 52 e os 65 anos e, tal como o mieloma múltiplo, é mais comum em indivíduos de ascendência africana, o que torna este caso ainda menos frequente por se tratar de um indivíduo caucasiano com 75 anos de idade com a forma primária da doença.
Os mecanismos pelos quais os plasmócitos entram em circulação ainda não são bem conhecidos, embora já haja diferenças do ponto de vista imunohistoquímico e genómico entre a leucemia a plasmócitos e o mieloma múltiplo.
Sendo esta uma forma agressiva de mieloma múltiplo, é expectável que o burden tumoral seja grande, sendo comum a apresentação com anemia grave, leucocitose, hipercalcémia e trombocitopenia a condicionar diátese hemorrágica, sendo também comum a existência de hepatosplenomegália, adenopatias periféricas, derrame pleural ou até sinais neurológicos (se envolvimento do Sistema Nervoso Central). 11 Este caso torna-se também interessante por ter poucos dados clínicos sugestivos, nomeadamente ausência de alterações relevantes ao exame objectivo e anemia e leucocitose discretas. No entanto, o doente apresentou vários indicadores de mau prognóstico como disfunção renal acentuada, hipercalcémia grave, β2-microglobulina elevada e a existência de proteinúria. A leucemia a plasmócitos é mais frequentemente apenas de cadeias leves, sendo mais frequentes as formas IgE e IgD do que IgG e IgA, sendo que apresentamos um caso IgG/lambda. 10
Estes doentes têm habitualmente um prognóstico reservado, com uma sobrevida média de 6 a 11 meses, sendo que um terço dos doentes vem a falecer no primeiro mês após o diagnóstico, havendo alterações citogenéticas associadas com pior prognóstico (9). Historicamente, o tratamento tem sido com intuito paliativo, no entanto os dados dos novos agentes terapêuticos como o bortezomib e a lenalidomida são promissores na melhoria do prognóstico destes doentes. O doente apresentado mostrou uma boa resposta terapêutica a estes novos fármacos, mantendo-se clinicamente estável 1 ano após o diagnóstico, o que confirma a expectativa de que estes novos protocolos terapêuticos trarão um aumento da sobrevida média dos doentes com leucemia a plasmócitos.
Quadro I
Avaliação analítica à admissão
| Hemoglobina (g/dl) | 10,7 | Creatinina (mg/dl) | 5,34 | Cálcio corrigido (mg/dl) | 15,3 | Pressão parcial arterial de dióxido de carbono (mmHg) | 38 |
| Leucócitos (/µl) | 12390 | Sódio (mmol/l) | 131 | Cálcio ionizado (mmol/l) | 1,94 | Pressão parcial arterial de oxigénio (mmHg) | 82 |
| Neutrófilos (%) | 65,2 | Potássio (mmol/l) | 4,5 | Fósforo (mg/dl) | 6,2 | Saturação periférica arterial de oxigénio (%) | 97 |
| Plaquetas (/µl) | 157000 | Cloro (mmol/l) | 95 | Albumina (g/dl) | 2,8 | Bicarbonato (mmol/l) | 31,0 |
| Ureia (mg/dl) | 133 | PCR (mg/dl) | 0,64 | pH arterial | 7,52 | Lactato (mmol/l) | 0,5 |
Quadro II
Avaliação analítica adicional
| β2-microglobulina (µg/ml) | 15,3 | α1-globulina (g/dl) | 0,5 (3,8%) | IgG (mg/dl) | 9856 |
| Ácido úrico (mg/dl) | 14,0 | α2-globulina (g/dl) | 1,0 (7,7%) | IgA (mg/dl) | <15 |
| Hormona paratiroideia (pg/ml) | 7,6 | β1-globulina (g/dl) | 0,4 (3,1%) | IgM (mg/dl) | 8 |
| Proteínas totais (g/dl) | 13,0 | β2-globulina (g/dl) | 0,3 (2,3%) | IgD (KU/l) | <24,0 |
| Albumina (g/dl) | 3,0 (23,1%) | γ-globulina (g/dl) | 7,8 (60,0%) | IgE (U/ml) | <1,5 |
| Antigénio específico da próstata (ng/ml) | 1,87 | Velocidade de sedimentação (mm/h) | 77 |
Quadro III
Evolução dos valores de hemoglobina, creatinina, cálcio e fósforo
| D1 | D2 | D3 | D4 | D7 | D10 | |
| Hemoglobina (g/dl) | 10,6 | 9,6 | 10,5 | 10,7 | 10,2 | 9,2 |
| Creatinina (mg/dl) | 5,38 | 4,95 | 4,68 | 4,19 | 2,27 | 1,54 |
| Cálcio corrigido (mg/dl) | 14,3 | 16,4 | 13,4 | 11,9 | 8,7 | 8,8 |
| Fósforo (mg/dl) | 6,2 | 7,6 | 6,6 | 5,7 | - | 2,3 |
Figura I
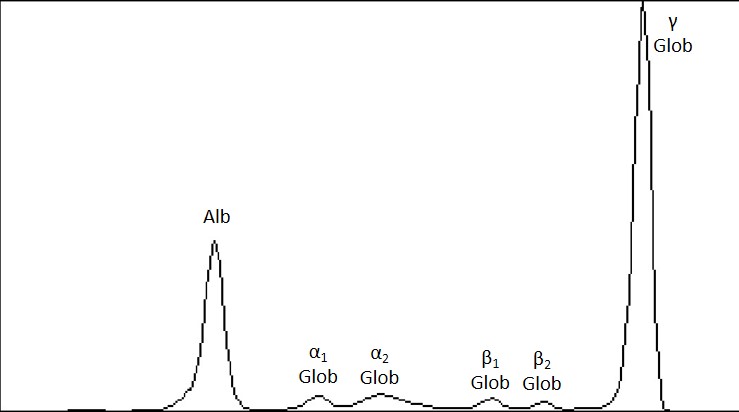
Electroforese de proteínas, evidenciando pico monoclonal na região gama
Figura II
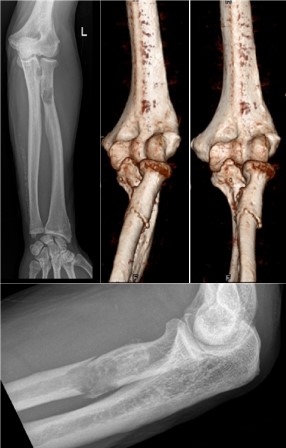
Radiografia e reconstrução 3D por TC do cotovelo esquerdo, evidenciando fractura por lesão lítica na extremidade proximal do rádio
BIBLIOGRAFIA
1. UpToDate: ‘Pathobiology of multiple myeloma’. S Vincent Rajkumar. Dec 2018.
2. ‘Pathogenesis and treatment of myeloma kidney’. Sanders PW. J Lab Clin Med. 1994;124(4):484.
3. ‘Renal failure in multiple myeloma: presenting features and predictors of outcome in 94 patients from a single institution’. BladéJ, Fernández-Llama P, Bosch F, Montolíu J, Lens XM, Montoto S, Cases A, Darnell A, Rozman C, Montserrat E. Arch Intern Med. 1998;158(17):1889.
4. ‘Renal failure in multiple myeloma: reversibility and impact on the prognosis’. Nordic Myeloma Study Group. Knudsen LM, Hjorth M, Hippe E. Eur J Haematol. 2000Sep;65(3):175-81.
5. Uptodate: ‘Hypercalcemia of malignancy: Mechanisms’. Mara J Horwitz. Dec 2018.
6. ‘Biology and treatment of myeloma related bone disease’. Evangelos Terpos, Dimitrios Christoulas, Maria Gavriatopoulou. Metabolism Journal. March 2018. Vol 80. Pgs 80-90.
7. ‘Plasma cell leukemia: consensus statement on diagnostic requirements, response criteria and treatment recommendations by the International Myeloma Working Group’.International Myeloma Working Group. Leukemia. 2013;27(4):780. Epub 2012 Nov 21.
8. UpToDate: ‘Plasma Cell Leukemia’. S Vincent Rajkumar. Dec 2018.
9. ‘Managing plasma cell leukemia’. Morie A Gertz. Leukemia & Lymphoma, 2007; 48(1):5-6.1
10. Grogan TM, Coupland RW, Kyle RA, Kuehl WM, Harris NL, McKenna RW. Plasma cell neoplasm. World Health Organization Classification of Tumours of Haematopoietic and Lymphoid Tissues. Lyon: IARC Press; 2009. p. 203
11. Gangadhar P, Ahmed Z, Pai MR, Sandhya I. Primary plasma cell leukemia: A report of two cases of a rare and aggressive variant of plasma cell myeloma with the review of literature. Indian J Pathol Microbiol 2016;59:5414

