Introdução: O pseudomixoma peritoneal (PMP) é uma entidade clínica pouco comum, com uma incidência estimada de 2 casos por milhão por ano.1Define-se pela acumulação intraperitoneal de muco, com origem numa neoplasia mucinosa.2Este muco, em conjunto com as células tumorais, acompanham a circulação normal do fluido peritoneal e são “redistribuídas” dentro da cavidade peritoneal, acumulando em locais de absorção linfática do fluido e pela ação da gravidade, poupando as ansas móveis do intestino delgado e depositando-se na pélvis, omento, cápsula do fígado e nas goteiras paracólicas.2–4
Caso clínico: Descreve-se o caso de um homem de 62 anos, com antecedentes de diabetes mellitus tipo 2, hiperplasia benigna prostática, gastrite crónica e consumo ocasional de álcool, que recorreu ao serviço de urgência por aumento progressivo do perímetro abdominal e perda ponderal involuntária de 5 quilogramas nos últimos 6 meses. Objetivamente, apresentava-se apirético, vigil, mucosas coradas e hidratadas, conjuntivas anictéricas, auscultação cardíaca e pulmonar sem alterações; sem ginecomastia; abdómen distendido, sem sinais de circulação colateral, maciço à percussão, sem sinal de onda ascítica, com ruídos hidroaéreos presentes e membros inferiores não edemaciados. Analiticamente, sem alterações do hemograma, coagulação, perfil hepático, função renal ou das enzimas pancreáticas. Efetuou ecografia abdominal que descrevia “abundante derrame peritoneal, heterogéneo, septado, com espessamento do grande omento, observando-se ainda espessamento peritoneal sobre a retrocavidade dos epiploons”. A tomografia computorizada (TC) com contraste (Fig.1, 2 e 3) descrevia “dismorfia hepática, com hipertrofia do lobo caudado e esquerdo, sem lesões focais, nomeadamente, imagens compatíveis com hepatocarcinoma. O contorno hepático apresenta-se irregular, com entalhes, o mesmo acontecendo em relação ao baço, o que está em provável relação com o derrame peritoneal abundante existente que apresenta sinais de organização e folhetos espessados. A vesícula biliar está distendida, sem litíase. Baço com dimensões conservadas, sem alterações focais. Glândulas pancreática e suprarrenais sem alterações. Espessamento do grande omentum. Sem adenomegalias lomboaórticas ou na escavação pélvica.”
Dada a dificuldade técnica na realização de paracentese diagnóstica, optou-se pela realização de biópsia do omento guiada por TC. Na análise anatomopatológica do espécimen obtido encontrou-se “abundante muco, algum material hemático e fibrinóide, com alguns polimorfonucleares, células isoladas, com caraterísticas tipo macrofágico, e células mesoteliais de caraterísticas reativas. Pequenos retalhos soltos de epitélio mucoso, constituído por camada celular única e sem evidente atipia nuclear valorizável, observando-se, por vezes, ligeira hipercromaticidade e pseudoestratificação nucleares, sem perda da polaridade nuclear, nem mitoses, não sendo evidente displasia de alto grau. Os aspetos descritos são compatíveis com pseudomixoma peritoneal”. Prosseguiu-se o estudo, no sentido de identificar o foco primário. O estudo endoscópico revelou apenas conteúdo biliar na cavidade gástrica e a nível do cólon não foram detetadas alterações, embora, devido a dificuldades técnicas, só se tenha visualizado o cego à distância. Não foram identificadas lesões na cintigrafia óssea, nem na TC do tórax. No estudo analítico, destacou-se apenas elevação dos marcadores tumorais Antigénio Carcino-Embrionário (CEA) (13,9ng/mL), CA 125 (55,4U/mL) e CA 72.4 (171,3U/mL), sendo o CA 19.9 normal. O doente foi referenciado para uma equipa de cirurgia diferenciada em tumores peritoneais e submetido a cirurgia citorredutora (CRS) com quimioterapia intraperitoneal hipertérmica (HIPEC), neste caso, Mitomicina C, com omentectomia, colecistectomia, peritonectomia, esplenotomia, colectomia total com apendicetomia e excisão do íleon distal, com respetivas análises anatomopatológicas. Estas revelaram “lagos de muco acelulares e células neoplásicas mucinosas de baixo grau”, nos espécimes observados, e extensa ulceração do apêndice cecal, confirmando o diagnóstico de PMP de baixo grau.
Discussão: O PMP é um diagnóstico infrequente na prática clínica diária, dada a sua baixa incidência. Geralmente diagnosticado em doentes entre os 40 e os 55 anos de idade, surge frequentemente como diagnóstico incidental em laparoscopias e exames de imagem. A doença localizada pode manifestar-se por um quadro sugestivo de apendicite ou pelo aparecimento de uma massa pélvica de novo. Mas a maioria dos casos, dada a sua evolução indolente, surge em fase avançada, com distensão abdominal maciça, hérnia abdominal de novo, obstrução intestinal e ascite,5conduzindo a desnutrição, perda ponderal e um prognóstico mais reservado.
A neoplasia mucinosa do apêndice é o foco primário mais frequentemente descrito, mas, ocasionalmente, são reportados casos com origem no ovário, cólon, estômago, pâncreas e úraco2,6,7. Dada a referência a vários focos primários, a classificação do PMP baseia-se na apresentação histológica e define-se em 3 categorias: baixo grau, alto grau e alto grau com células em “anel de sinete”.2Esta categorização e o foco primário correlacionam-se com o prognóstico, encontrando-se um prognóstico mais reservado em tumores colorretais, que simultaneamente se associam a um grau de diferenciação histológica superior e metastização, embora esta seja rara.8Neste caso, não se encontrou o foco primário, apesar de o apêndice cecal se apresentar ulcerado.
A descrição histológica neste caso sugere um diagnóstico de PMP de baixo grau, porém foram detetados valores elevados de CEA e CA 125. Na revisão da literatura, alguns artigos referem que a elevação dos marcadores tumorais serológicos CEA, CA 125 e CA 19.9 têm um valor prognóstico independente da histologia, estando associados a maior taxa de recorrência e menor sobrevivência.4,9
Apesar de as primeiras referências patológicas e a nomenclatura Pseudomyxoma peritonei ter surgido em 1884 por Werth10, foi apenas em 1995 com Sugarbaker et al.11que surgiu a primeira técnica de tratamento eficaz, utilizando a quimioterapia intraperitoneal no pós-operatório imediato de resseção tumoral, à semelhança do tratamento preconizado atualmente: a CRS com HIPEC12, com uma taxa de sobrevivência a 5 anos elevada (82% num estudo de 2020 doentes realizado por Chua et al.13). A HIPEC consiste na infiltração intraoperatória de quimioterapia na cavidade abdominal, em condições hipertérmicas (40-41º graus Celsius), através de um circuito extracorporal, durante 60 minutos. Este procedimento permite alcançar concentrações de fármaco mais elevadas na cavidade peritoneal, do que a quimioterapia endovenosa, e tem como objetivo erradicar depósitos tumorais residuais que permaneçam após a resseção cirúrgica.14
A referenciação para um centro cirúrgico especializado é determinante no tratamento adequado, uma vez que apenas alguns possuem a possibilidade de realização de HIPEC.
Apesar de se tratar de uma patologia há muito relatada pela primeira vez, os escassos estudos realizados incluem pequenas amostras populacionais, dada a raridade desta patologia. No entanto, destaca-se um estudo realizado por Järvinen et al.15, que demonstrou que apesar das taxas de sobrevivência a 5 anos da CRS com e sem HIPEC serem semelhantes (67% e 69%, respetivamente), a taxa de recorrência da doença era bastante superior na CRS sem HIPEC (54% comparado com 9%).
Figura I
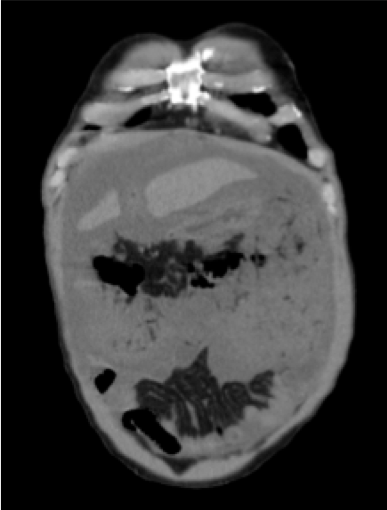
Derrame peritoneal abundante com sinais de organização e folhetos espessados.
Figura II
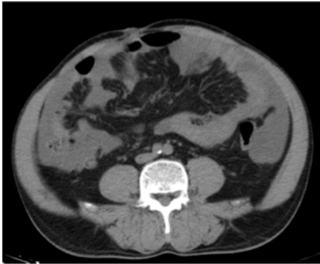
“Omental cake”
Figura III
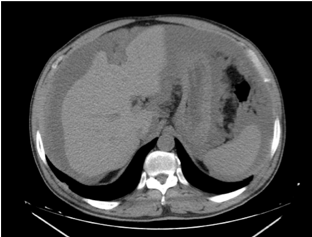
Dismorfia hepática com entalhes na superfície.
BIBLIOGRAFIA
1. Smeenk RM, van Velthuysen MLF, Verwaal VJ, Zoetmulder FAN. Appendiceal neoplasms and pseudomyxoma peritonei: a population based study. Eur J Surg Oncol. 2008 Feb;34(2):196–201.
2. Carr NJ, Cecil TD, Mohamed F, Sobin LH, Sugarbaker PH, Gonzalez-Moreno S, et al. A Consensus for Classification and Pathologic Reporting of Pseudomyxoma Peritonei and Associated Appendiceal Neoplasia: The Results of the Peritoneal Surface Oncology Group International (PSOGI) Modified Delphi Process. Am J Surg Pathol. 2016 Jan;40(1):14–26.
3. Sugarbaker PH. Pseudomyxoma peritonei. A cancer whose biology is characterized by a redistribution phenomenon. Ann Surg. 1994 Feb;219(2):109–11.
4. Mittal R, Chandramohan A, Moran B. Pseudomyxoma peritonei: natural history and treatment. Int J Hyperth. 2017 Jul 4;33(5):511–9.
5. Rizvi SA, Syed W, Shergill R. Approach to pseudomyxoma peritonei. World J Gastrointest Surg. 2018 Aug 27;10(5):49–56.
6. Agrawal AK, Bobinski P, Grzebieniak Z, Rudnicki J, Marek G, Kobielak P, et al. Pseudomyxoma peritonei originating from urachus-case report and review of the literature. Curr Oncol. 2014 Feb;21(1):e155-65.
7. Wang W, Meng L, Crespo E, Adams J, Manoucheri M. Gelatinous Abdomen: A Rare Case of Pseudomyxoma Peritonei Arising from Metastatic Gastric Adenocarcinoma. Cureus. 2019 May 14;11(5):e4666–e4666.
8. Carr NJ, Finch J, Ilesley IC, Chandrakumaran K, Mohamed F, Mirnezami A, et al. Pathology and prognosis in pseudomyxoma peritonei: a review of 274 cases. J Clin Pathol. 2012 Oct 1;65(10):919 LP – 923.
9. Taflampas P, Dayal S, Chandrakumaran K, Mohamed F, Cecil TD, Moran BJ. Pre-operative tumour marker status predicts recurrence and survival after complete cytoreduction and hyperthermic intraperitoneal chemotherapy for appendiceal Pseudomyxoma Peritonei: Analysis of 519 patients. Eur J Surg Oncol. 2014 May;40(5):515–20.
10. Werth R. Kliniche und anastomische untersuchungen zur lehre von der bauchgeschwullsten und der laparotomy. Pseudomyxoma Paeritonei. Arch Gynecol Obs. 1884;24:100–18.
11. Sugarbaker PH. Peritonectomy procedures. Ann Surg. 1995 Jan;221(1):29–42.
12. Moran B, Baratti D, Yan TD, Kusamura S, Deraco M. Consensus statement on the loco-regional treatment of appendiceal mucinous neoplasms with peritoneal dissemination (pseudomyxoma peritonei). J Surg Oncol. 2008 Sep;98(4):277–82.
13. Chua TC, Moran BJ, Sugarbaker PH, Levine EA, Glehen O, Gilly FN, et al. Early- and long-term outcome data of patients with pseudomyxoma peritonei from appendiceal origin treated by a strategy of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy. J Clin Oncol. 2012 Jul;30(20):2449–56.
14. Pasquali S, Sommariva A, Mahteme H, Suo T, Ma H, Tropea S, et al. Cytoreductive surgery alone or combined with hyperthermic intraperitoneal chemotherapy (HIPEC) for pseudomyxoma peritonei. Cochrane Database Syst Rev. 2018 Sep 6;2018(9):CD005659.
15. Jarvinen P, Ristimaki A, Kantonen J, Aronen M, Huuhtanen R, Jarvinen H, et al. Comparison of serial debulking and cytoreductive surgery with hyperthermic intraperitoneal chemotherapy in pseudomyxoma peritonei of appendiceal origin. Int J Colorectal Dis. 2014 Aug;29(8):999–1007.




