Introdução
O hiperaldosteronismo primário (HAP) caracteriza-se por uma secreção aumentada de aldosterona, independente do eixo renina-angiotensina. Embora seja subdiagnosticado, é considerado uma causa secundária, curável, de hipertensão arterial, sendo aliás, a causa endócrina mais comum desta última.
1 Estima-se que afete entre 4.3% a 9.5% da população, mas por ser pouco rastreado, a sua prevalência é ainda indefinida.
9 Os adenomas produtores de aldosterona e a hiperplasia bilateral das supra-renais são as duas causas mais frequentes de HAP.
3 Os achados clínicos habitualmente cursam com hipertensão arterial grau II ou III, alcalose metabólica e hipocalémia, embora em alguns casos esta última não esteja presente, dificultando o diagnóstico.
2 Apesar de menos comum, por vezes as manifestações inaugurais do HAP podem ser neuromusculares, incluindo parestesias, fasciculações, tetania ou fraqueza muscular na forma de tetraparésia proximal simétrica.
3.7 Nestes casos, o diagnóstico pode ser mais complexo, sendo necessário conhecer a variabilidade do espectro clínico da doença para que haja suspeição da mesma.
Neste trabalho descreve-se um caso de hiperaldosteronismo primário, cuja apresentação inicial foi uma miopatia metabólica secundária à hipocalémia.
Caso Clínico
Descreve-se o caso de um homem com 64 anos, autónomo, leucodérmico. Tinha como antecedentes pessoais hipertensão arterial com diagnóstico aos 45 anos, com cardiopatia hipertensiva como lesão de órgão alvo. Estava medicado com associação de ramipril 5mg/dia, nebivolol 5mg/dia, felodipina 10mg/dia e hidroclorotiazida 25mg/dia. Descrevia episódios de contrações musculares involuntárias e fraqueza muscular de predomínio crural, auto-limitados e de resolução espontânea, com cerca de 10 anos de evolução. Por apresentar elevação flutuante das enzimas musculares tinha sido estudado em consulta de Neurologia, tendo realizado inclusivamente eletromiografia e biopsia muscular, cujo resultado não mostrou alterações relevantes, pelo que teve alta da consulta sem diagnóstico definido.
O doente recorreu ao serviço de urgência em agosto de 2018 por quadro de contrações musculares involuntárias, dolorosas e generalizadas, de instalação súbita, mais intensas do que o habitual, associadas a fraqueza muscular generalizada, incapacitante e a condicionar dispneia para mínimos esforços. Sem outra sintomatologia associada. Objetivamente apresentava-se bem acordado e orientado, com elevação da pressão arterial sistodiastólica (sustentadamente superior 170/100mmHg), apirético, normocárdico e com saturação periférica de oxigénio superior a 94% em ar ambiente. Eram visíveis contrações musculares involuntárias (tetania), intermitentes, associadas a pequenas fasciculações e a presença de tetraparésia proximal simétrica. Os exames complementares de diagnóstico mostraram a presença de alcalose metabólica compensada, hipocalémia e hipomagnesemia graves, elevação das enzimas musculares e disfunção renal (tabela 1). O hemograma e o exame sumário de urina com sedimento eram normais e não apresentava síndrome inflamatório. O electrocardiograma apresentava ritmo sinusal, mas com prolongamento do intervalo QT (470ms) e a telerradiografia de tórax não mostrava alterações relevantes. A ecografia renovesical excluiu causa obstrutiva da lesão renal aguda.
O doente iniciou correção dos distúrbios iónicos e foi admitido em internamento na Unidade de Cuidados Intermédios. Mesmo sem estudo etiológico, assumindo a gravidade do quadro clínico e a alta probabilidade de hiperaldosteronismo primário, foi iniciado tratamento com espironolactona na dose de 200mg/dia. O doseamento dos iões urinários (sódio, potássio e magnésio) foi normal. Colheu posteriormente o ratio aldosterona/renina (RAR), sendo este elevado (valor 142 pg/ml), e já sob terapêutica com antagonista dos mineralocorticoides há mais de 3 dias. Após esta medida e a correção de todos os distúrbios iónicos, verificou-se rápida melhoria, com controlo do perfil tensional, normalização das enzimas musculares e da função renal e resolução dos sintomas neuromusculares. Durante o internamento o doente ainda realizou tomografia computorizada abdominal que mostrou nódulos bilaterais nas glândulas supra-renais, sugestivo de adenomas funcionantes (figura 1). Evoluiu de forma favorável e teve alta ao 5º dia de internamento, sob terapêutica com ramipril 5mg/dia e espironolactona 200mg/dia, tendo sido orientado a consulta de Endocrinologia para estudo complementar e orientação.
Na consulta de Endocrinologia foi alterada a terapêutica anti-hipertensora: suspendeu o ramipril e a espironolactona e iniciou um antagonista dos canais de cálcio (verapamilo em dose titulada até 320mg/dia) e manteve a suplementação oral com magnésio e potássio durante seis semanas. Após este período temporal (de washout farmacológico), realizou prova de supressão salina endovenosa (tabela 2), que mostrou a incapacidade de supressão dos níveis de aldosterona, confirmando o diagnóstico de hiperaldosteronismo primário provavelmente secundário a adenomas funcionantes das supra-renais. Posteriormente retomou a espironolactona na dose de 100mg/dia, sendo associada amlodipina 10mg/dia para controlo tensional adequado. De salientar que foram excluídas outras causas de hipertensão secundária, nomeadamente renovasculares como a estenose das artérias renais e endócrinas, como a co-secreção de cortisol através do doseamento de cortisoluria nas 24h e a prova de supressão noturna com dexametasona, assim como a produção de catecolaminas pelo doseamento das metanefrinas fracionadas na urina de 24h. Após cerca de um ano de vigilância, o doente mantém-se assintomático, com normocalémia, sem sintomas neuromusculares e com normalização das enzimas musculares.
Discussão
O hiperaldosteronismo primário ou doença de Conn foi descrito pela primeira vez por Jerome W. Conn em 1955, numa mulher de 34 anos com hipertensão arterial, hipocalémia e alcalose metabólica, tendo sido considerada uma condição rara.6
A prevalência estimada da doença há algumas décadas atrás era de 0.05-2%. No entanto, nos últimos anos, pelo maior reconhecimento médico e das técnicas de diagnóstico, a prevalência do HAP aumentou, estimando-se que atualmente afete entre 4.3% a 9.5% da população. Este número aumenta para aproximadamente 20%, se se considerarem apenas os casos de hipertensão arterial resistente.5
Os adenomas produtores de aldosterona e a hiperplasia idiopática da supra-renal são responsáveis por cerca de 65% e 25% dos casos de HAP, respetivamente.6
A doença cursa habitualmente com hipertensão arterial de difícil controlo, alcalose metabólica e hipocalémia.1 Esta última não é um requisito para o diagnóstico5, no entanto, quando presente, pode estar associada a alterações neuromusculares como miopatia, paralisia intermitente, tetania ou desconforto muscular.4 Sendo a hipocalémia uma causa reconhecida de rabdomiólise, embora seja desconhecido o mecanismo fisiopatológico exato que as associa8, sabe-se que quando o potássio se encontra em níveis séricos inferiores a 2.5mEq/L, tende a ocorrer elevação das enzimas musculares como a creatina cinase ou a mioglobina.4 A resolução dos sintomas neuromusculares e a normalização da rabdomiólise após a correção da hipocalémia com suplementos orais ou endovenosos de potássio é a favor de se tratar de uma miopatia hipocalémica6, uma vez que esta condição clínica pode mimetizar miopatias inflamatórias como a polimiosite, cuja evolução é modificada apenas pela introdução de corticoterapia ou terapêutica imunossupressora. 2,3
No caso do HAP, os exames de imagem, como a tomografia computorizada, podem apoiar a suspeita diagnóstica (se identificados adenomas ou hiperplasia das supra-renais), sendo que a sua confirmação exige a documentação de uma produção aumentada e autónoma de aldosterona.1 O ratio aldosterona/renina, pode ser um bom método de rastreio1 (é considerado positivo se, em pelo menos 2 colheitas, se obtiver um RAR > 57pg/mL)11, mas o diagnóstico deverá ser confirmado por métodos mais fidedignos, como a prova de sobrecarga salina oral ou endovenosa.4,10
Após a confirmação do diagnóstico de HAP, o tratamento poderá passar por métodos farmacológicos (espironolactona) ou cirúrgicos (suprarrenalectomia) de acordo com a etiologia definida.1
No caso particular descrito neste artigo, trata-se de um homem com hipertensão arterial de diagnóstico em idade jovem, com critérios de resistência e com lesão de órgão alvo. A apresentação inicial de todo o quadro foi de miopatia metabólica hipocalémica complicada com rabdomiólise e consequente lesão renal por pigmentos. A presença de hipertensão arterial não controlada, assim como os achados na tomografia computorizada, contribuíram para a suspeita diagnóstica de HAP. A toma de hidroclorotiazida poderá ter contribuído para a gravidade dos distúrbios iónicos, acentuando a hipomagnesemia e hipocalémia. Pela gravidade da sintomatologia e dos distúrbios iónicos, já a condicionar atingimento multiorgânico (renal, muscular e cardíaco) com necessidade de tratamento urgente, não foi possível a realização de electromiografia, biopsia muscular ou testes hormonais na fase aguda, tendo iniciado tratamento com base no diagnóstico presuntivo. A rápida resolução dos achados sintomáticos e analíticos, após normalização da caliemia e início da espironolactona, tornou a hipótese de HAP ainda mais provável. Em ambulatório, após seis semanas de suspensão do antagonista dos mineralocorticoides, a prova de sobrecarga salina endovenosa, veio confirmar o diagnóstico de HAP. A presença de níveis normais de renina não inviabiliza o diagnóstico, uma vez que, tal como descrito em alguns casos da literatura, após a exclusão de causas renovasculares, fatores como a restrição inadequada de água e sal e o uso de bloqueadores dos canais de cálcio para controlo tensional podem justificar o aumento da renina. Além disso, alguns estudos indicam que a própria hipertensão arterial grave causada pelo HAP pode levar a dano renal arteriolosclerótico intraglomerular que neutraliza a supressão da renina e acelera o curso da hipertensão.
Atendendo à presença de adenomas bilaterais e a dificuldade em estabelecer se a secreção de aldosterona seria uni ou bilateral e qual a lateralidade, dada a estabilidade e resposta clínica, e após discussão com o doente que recusou a realização de mais estudos complementares, foi decidido manter a terapêutica farmacológica.
Assim, com este caso demonstra-se uma apresentação atípica, na forma de miopatia hipocalémica, de uma entidade clínica relativamente comum em doentes com hipertensão arterial secundária, para a qual é necessária uma elevada suspeição para que seja estabelecido o diagnóstico correto de hiperaldosteronismo primário.
Quadro I
Resultados analíticos na admissão
| Análise | Valor | Análise | Valor |
| Sódio (mmol/L) | 144 | Lactato desidrogenase (U/L) | 495 |
| Potássio (mmol/L) | 2.0 | Creatinina cinase (U/L) | 2250 |
| Magnésio (mmol/L) | ‹0.25 | Mioglobina (ng/ml) | 788 |
| Ureia (mg/dl) | 62 | Proteina C reativa (mg/L) | 15.6 |
| Creatinina (mg/dl) | 1.8 | TSH (µUl/ml) | 1.52 |
| TGO (U/L) | 35 | Sumária de urina | Normal |
| TGP (U/L) | 28 | | |
| | | | |
| | | | |
Resultados do estudo analítico na admissão no serviço de urgência. TGO - transaminase glutâmico-oxalacética; TGP - transaminase glutâmico-pirúvica; TSH - thyroid-stimulating hormone.
Quadro II
Prova de sobrecarga salina endovenosa
| Tempo 0 | Resultados | Limite normal |
| Potássio (mmol/L) | 3.2 | 3.5-5.1 |
| Concentração de Renina Ativa (pg/mL) | 7.6 | Decúbito: 1,0-8,2 Ortostatismo: 1,3-13,8 |
| Aldosterona (ng/dL) | 84.4 | Decúbito: 1,0-16,0 Ortostatismo: 4,0-31,0 |
| Tempo 4 | Resultados | Limite normal |
| Potássio (mmol/L) | 2.9 | 3.5-5.1 |
| Concentração de Renina Ativa (pg/mL) | 6.5 | Decúbito: 1,0-8,2 Ortostatismo: 1,3-13,8 |
| Aldosterona (ng/dL) | 55.9 | Decúbito: 1,0-16,0 Ortostatismo: 4,0-31,0 |
| | | |
| | | |
Resultados dos doseamentos hormonais durante a prova de sobrecarga salina endovenosa, realizada com o doente em posição sentada. (Tempo 0 – antes da administração de 2000ml de soro fisiológico; Tempo 4 – depois da infusão de soro fisiológico em 4h, a um ritmo de 500ml/h); A prova é considerada positiva quando o valor de aldosterona é superior a 5ng/dL.
Figura I
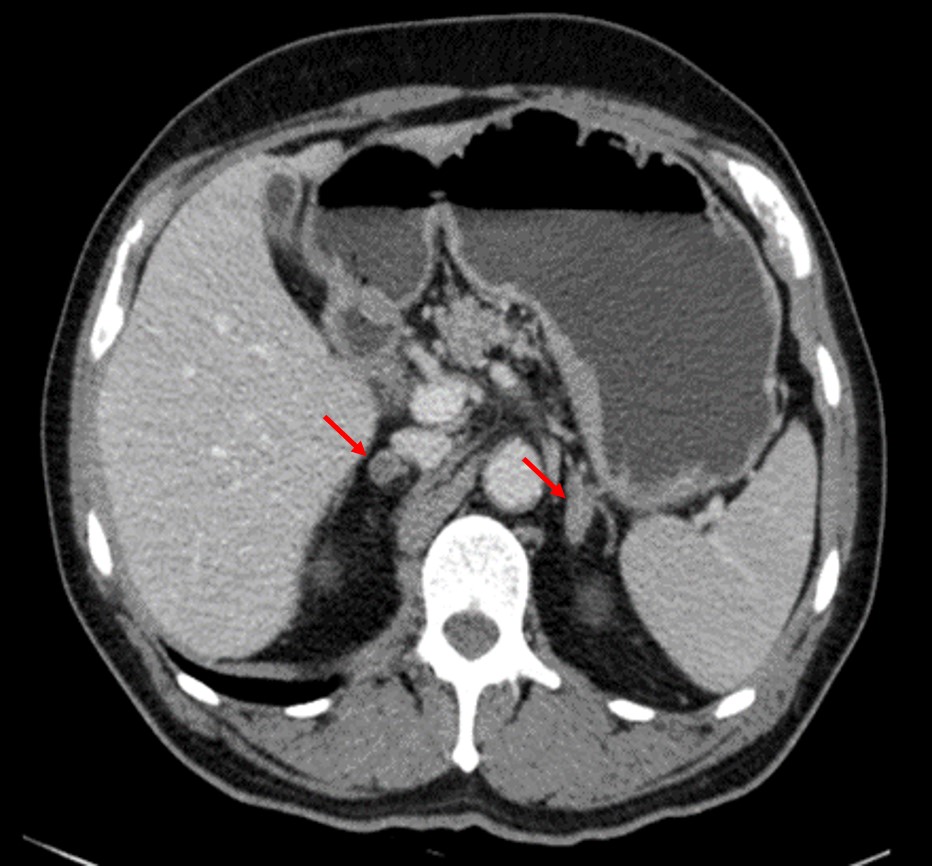
Tomografia computorizada abdominal a mostrar formações nodulares captantes heterogéneas em ambas as glândulas suprarrenais (setas vermelhas), à direita com 13 mm e à esquerda com 22 mm x 12 mm, sugestivas de adenomas das supra-renais.
BIBLIOGRAFIA
1. Rossi GP. A comprehensive review of the clinical aspects of primary aldosteronism. Nat Rev Endocrinol. 2011. 7(8):485-95
2. Moura AS, Costa de Freitas R. Periodic Paralysis: an uncommon complication of primary aldosteronism. Arq Bras Endocrinol Metab. 2003. 1677-9487
3. Lei W, Zhu C, Jing L, et al. Hypokalemic myopathy in primary aldosteronism: a case report. Exp Ther Med. 2016. 12(6):4064-4066
4. Martinez J, Oliveira C, Meneses LM, et al. Rabdomyolysis due to primary hyperaldosteronism. Endocrinol Nutr. 2009. 56(8): 431-4
5. Kotsaftis P, Savopoulos C, Agapakis D, et al. Hypokalemia induced myopathy as first manifestation of primary hyperaldosteronism – an elderly patient with unilateral adrenal hyperplasia: a case report. Cases Journal. 2009. 2:6813
6. Brandão DA, Martins Ferreira DB, Oliveira Tavares D et al. Hiperaldosteronismo primário simulando polimiosite. Relato de caso. Rev Bras Clin Med. 2013. 11 (3): 303-5
7. Goto A, Takahashi Y, Kishimoto M et al. Primary aldosteronism associated with severe rhabdomyolysis due to profound hypokalemia. Inter Med. 48: 219-223
8. Rong HE, Wen-Jia GUO, Fei SHE et al. A rare case of hypokalemia-induced rabdomyolysis. J Geriatr Cardiol. 2018. 15:321-324
9. Fernandes V, Silva T, Almeida R et al, Hiperaldosteronismo primário: resultados do primeiro estudo multicêntrico português realizado pelo Grupo de Estudos de Tumores da Supra-renal. Rev Port Endocrinol Diabetes Metab. 2016. 11(2): 163-170
10. Carvalho A, Carvalho R. Hiperaldosteronismo primário – novas perspectivas. Rev Port Endocrinol Diabetes Metab. 2008. Vol 3, nº2
11. Funder JW, Carey RM, Mantero F et al, The Management of Primary Aldosteronism:Case Detection, Diagnosis, and Treatment: An Endocrine Society Clinical Practice Guideline, J Clin Endocrinol Metab, 2016, 101(5):1889 –1916


