Introdução
As manifestações das doenças linfoproliferativas são variadas exigindo o diagnóstico diferencial com doenças autoimunes, infeciosas e neoplasias sólidas. A serosite, principalmente o derrame pleural, é uma forma de apresentação comum nos linfomas (20-30% dos casos), contrariamente ao derrame pericárdico e à artrite, que são raramente observados.1 Por outro lado, estes últimos, são comuns nas doenças auto-imunes e infeciosas.2 O linfoma difuso de grandes células B (LDGCB) é o tipo de linfoma não-Hodgkin mais comum. 3 A doença primária ganglionar ocorre em cerca de 60% dos casos e dos 40% que se manifestam com uma forma extraganglionar a maioria tem expressão gastrointestinal.
Caso clínico
Mulher de 68 anos de idade, com antecedentes patológicos de hipotiroidismo e síndrome depressivo. Internada para estudo de quadro de poliartralgias das pequenas e grandes articulações, de início insidioso e agravamento progressivo, com 3 meses de evolução. Estas caracterizavam-se como simétricas, aditivas de ritmo inflamatório, com envolvimento inicial das articulações da mão direita e com posterior irradiação para as articulações da mão esquerda, punhos, região cervical, joelhos, tornozelos e pés. Adicionalmente, apresentaram refratariedade aos anti-inflamatórios não esteroides (AINEs) e outros analgésico não-AINEs. Negava febre, alterações cutâneas, hipersudorese noturna ou quadro constitucional. A investigação de ambulatório revelou elevação dos parâmetros inflamatórios (com valores de velocidade de sedimentação (VS) e proteína C reativa (PCR) de 118mm e 96mg/dL, respetivamente). Ao estudo radiográfico foram identificados sinais incipientes de peri-artrite da articulação escapulo-umeral. A tomografia computorizada (TC) cervical não evidenciou alterações. Ao exame objetivo destacaram-se alterações articulares sugestivas de artrite e sinovite da mão direita: crepitações na linha articular, edema, rubor, calor e dor à mobilização das articulações metacarpofalângicas (MCF) e interfalângicas proximais (IFP). O estudo analítico evidenciou uma anemia (Hb:8,6g/dL) de doença crónica/inflamatória, aumento da VS para 46mm e da PCR para 24,54mg/dL, sem alterações do perfil/função hepática, renal, tiroidea, iónicas e coagulação e eletroforese das proteínas sem picos clonais. O estudo imunológico foi negativo: com ANA, anti-dsDNA, ANCA e ENA negativos, Fator Reumatoide ligeiramente aumentado, apesar de anti-citrulina negativo, (tabela 1) e doseamento de C3 e C4 e imunoglobulinas normais. A pesquisa de VHB, VHC, VIH foi negativa assim como as hemoculturas. Efetuou TC toraco-abdomino-pélvico (TC-TAP) que demonstrou pequeno derrame pleural bilateral, cardiomegalia, pequeno derrame pericárdico (Fig.1) e lesão quística complexa do rim esquerdo (Fig.2), sem evidência de adenopatias. Eletrocardiograma com ritmo sinusal, sem alterações de relevo e ecocardiograma transtorácico (ETT) com derrame pericárdico de pequeno volume e critérios de pericardite constritiva. Foi medicada com naproxeno, colchicina, tiocolquicosído e furosemida, evoluindo com apirexia sustentada, resolução das queixas álgicas, do edema periférico e descida dos marcadores inflamatórios. Teve alta orientada para consulta de medicina e de cardiologia para seguimento e continuação de estudo.
Após duas semanas, a doente foi reinternada por recrudescimento das poliartralgias, edema da face e membros inferiores. Na admissão, apresentava-se febril, com sinais de hipervolémia (edemas, derrame pleural, hipoproteinemia por enteropatia com perda de proteinas) e sintomatologia relacionada com redução de débito cardíaco, nomeadamente o cansaço para médios esforços. Realizou toracocentese diagnóstica, cujo resultado foi compatível com exsudado, sem isolamento de agente e ADA e PCR BK negativas. A anatomia-patológica não evidenciou células neoplásicas, sobreponível ao resultado da biópsia pleural. Atendendo aos achados prévios no ETT e sinais congestivos, repetiu novo ETT denotando-se agravamento da fisiologia constritiva. Realizou cateterismo cardíaco que demonstrou hipertensão pulmonar pós-capilar ligeira, baixo débito cardíaco (2.9L/min), baixo índice cardíaco (1.65L/min/m2) e diferença entre as pressões telediastólicas ventriculares >5mmHg e sem doença coronária. Estes achados foram interpretados no contexto da evolução da pericardite e de acordo com cardiologia sem indicação para descorticação do pericárdio sob risco de aumento da inflamação local. O quadro sistémico mantinha-se sem etiologia, havendo inclusivamente agravamento da anemia (Hb: 7,2g/dL), com necessidade de suporte transfusional. Por suspeita de síndrome paraneoplásica foi desenvolvida uma investigação etiológica extensa com estudos endoscópicos, ecografia mamária e da tiroide, exame ginecológico e citologia cervico-vaginal, não tendo sido identificadas alterações de relevo patológico. Realizou imunofenotipagem do sangue periférico sem populações anómalas, doseamento de imunoglobulinas e cadeias leves com elevação ligeira das cadeias leves lambda séricas e das cadeias leves Kappa na urina, mas com imunofixação normal (tabela 1). Efetuou ressonância magnética abdominal para melhor caracterização de quisto renal que foi compatível com classificação Bosniak III. Após avaliação por urologia ficou orientada para cirurgia de exérese do quisto.Do restante estudo analítico, ZN foi negativo no suco gástrico, ECA normal e IgM de CMV e Epstein Barr não reativos, IgG positivos e herpes simples negativo. Repetiu TC-TAP sem alterações de novo. Foi estabelecido o diagnóstico presuntivo de artrite seronegativa, com polisserosite, e pericardite constritiva, apesar de a síndrome paraneoplásica constituir diagnóstico diferencial. Teve alta mantendo naproxeno e colchicina. No CDP foi excluída tuberculose latente/ativa. Foi ainda orientada para consulta de Medicina Interna e Cardiologia.
Foi novamente internada por febre e poliartralgias, optando-se por iniciar corticoterapia com dose de 1mg/Kg/dia. A doente respondeu favoravelmente, com controlo da dor, redução sustentada de parâmetros inflamatórios e resolução completa de derrame pericárdico e pleural, reforçando a hipótese de diagnóstico previamente assumida. Após discussão do caso com equipa de autoimunes, a doente teve alta para consulta de reavaliação e para realização de biópsia das glândulas salivares, tendo sido medicada com esquema de desmame lento da corticoterapia, protelando-se os fármacos anti-reumatismais modificadores da doença até excisão da lesão renal.
Dois meses depois, ainda sob corticoterapia (prednisolona 20mg/dia), é novamente internada por clínica inespecífica e de novo, de tonturas em ortostatismo, toracalgia posterior esquerda associada a cervicalgia agravada com os movimentos. Á admissão, apresentava quadro subfebril, hipersudorese, TVJ, hipotensão (87/50mmHg) e taquicardia (110 bpm). Dos exames complementares de diagnóstico salienta-se o aumento dos marcadores laboratoriais de inflamação com VS de 26mm e PCR de 20,97 mg/dL, aumento da LDH para 494 U/I e hiperlactacidemia de 3,6 mmOl/L. Repetiu TC torácico que evidenciou múltiplas adenopatias, com conglomerados adenopáticos em território mediastínico, paratraqueal e subcarinal, epifrénico, infradiafragmáticas, retro-crurais, mesentéricas e peri-aórtico (Fig.3), lâmina de derrame pericárdico, derrame pleural ligeiro à direita e moderado à esquerda, lesões nodulares hipocaptantes inespecíficas do fígado e baço globoso. Colocou-se como hipótese diagnóstica mais provável doença linfoproliferativa. Repetiu imunofenotipagem de sangue periférico, do líquido pleural e realizou biópsia com imunofenotipagem de gânglio supra-clavicular. Durante o internamento, verificou-se agravamento clínico e analítico, com queda de hemoglobina para 6,7g/dl e disfunção multiorgânica, sendo transferida para Cuidados Intermédios, onde evolui para choque distributivo nas primeiras 24 horas. O resultado histológico do gânglio supra-clavicular, ainda nesse período, que revelou tratar-se de linfoma difuso de grandes células B com fenótipo de célula B ativada. Foi transferida para cuidados intensivos com apoio de Oncologia, contudo evoluiu de forma desfavorável acabando por falecer.
Discussão
O LDGCB representa cerca de 30% dos linfomas não Hodking.4 Condições de imunossupressão e infeções víricas por EBV, CMV, HIV ou hepatite C estão associados ao desenvolvimento deste linfoma o que não se constatou no caso apresentado. Contrariamente aos linfomas indolentes, que habitualmente se encontram disseminados na altura do diagnóstico, o LDGCB tende a apresentar-se com uma massa sintomática de crescimento rápido, com sintomas B associados: febre, hipersudorese noturna e perda ponderal.4, 5 A apresentação extra-nodal é menos comum, e geralmente acomete o sistema gastrointestinal, sistema nervoso central, ossos e estruturas não linfáticas da cabeça e pescoço.6 A serosite surge num tipo especifico destes linfomas, no linfoma primário das cavidades serosas associado à infeção pelo herpesvírus humano 8 (HHV8) e principalmente em doentes VIH positivos, achados que não se confirmaram.1, 7 A presença de serosite associada é um fator de mau prognóstico, associando-se ao risco acrescido de recorrência de doença pós-tratamento e de sobrevida reduzida. 1 No caso apresentado as manifestações foram inespecíficas impondo vários diagnósticos diferencias ad initio como doenças auto-imune, infeciosas e neoplasias. Contudo, a evolução clínica e o estudo desenvolvido ao longo dos internamentos, embora extenso e minucioso, eram sugestivos de artrite sero-negativa. As adenopatias e massas mediastínicas surgiram numa fase mais avançada da doença, o que não é frequente, atrasando o diagnóstico. Poderá existir a dúvida se o quadro inicial se tratava da apresentação clínica do LDGCB ou se este surgiu associado à artrite seronegativa, dado existirem estudos que relacionam a artrite inflamatória ou auto-imune a tipos específicos de linfoma (por exemplo, artrite reumatoide e LDGCB)8, no entanto o tempo de evolução de doença fazem os autores acreditar que a hipótese mais provável é de se tratar de LDGCB com apresentação atípica.
Quadro I
Resultados laboratoriais do estudo auto-imune e cadeias leves efectuados por internamento.
| Valores de referência | 1º Internamento | 2º Internamento | 3º Internamento | |
| A.N.A. | Negativo | |||
| A.N.C.A | Negativo | |||
| E.N.A. (nucleossomas, histonas, Sm, RNP/Sm; SSA, SSB, Jo-1, Scl-70) | Negativo < 8 Duvidoso 8 - 12 Positivo >= 12 | 6 | ||
| Anti-dsDNA | Negativo | |||
| Anticorpo anti-citrulina (U) | Negativo < 20 | 15,7 | ||
| Fator reumatoide (IU/ml) | 0-20 | 21,7 | ||
| Enzima conversora angiotensina (U/l) | 20 - 70 | 54 | ||
| HLAB27 | Positivo | |||
| C3 (mg/dl) | 79-152 | 136 | 136 | |
| C4 (mg/dl) | 16-38 | 24 | 25 | |
| IgA (mg/dl) | 66 - 436 | 306,0 | ||
| IgG (mg/dl) | 791 - 1643 | 1303 | ||
| IgM (mg/dl) | 43 - 279 | 166 | ||
| IgE Total (UI/ml) | 25.0 - 120.0 | 280,00 | ||
| Cadeias leves (kappa) – SORO (mg/l) | 6290-13500 | 10300 | ||
| Cadeias leves (Lambda) – SORO (mg/l) | 3130-7230 | 7450 | ||
| Eletroforese proteínas | Proteínas Totais 6.1 - 7.9 Albumina 54-68 Alfa 1 3-6 Alfa 2 7-13 Beta 7-14 Gama 10-20 | Proteínas Totais 5,8 g/dl Albumina 38 % Alfa 1 11 % Alfa 2 18 % Beta 11 % Gama 23 % | Proteínas Totais 5,4 g/dl Albumina 39 % Alfa 1 9 % Alfa 2 16 % Beta 13 % Gama 22 % | |
| TSH (uUI/ml) | 0.6-1.6 | 1,37 | ||
| T4 livre (ng/dl) | 0.38-5.4 | 1,572 | ||
| URINA | ||||
| Sedimento urinário | normal | normal | normal | |
| Cadeias leves Kappa (mg/dl) | 0.0-1.85 | 8,56 | ||
| Cadeias leves Lambda (mg/dl) | 0.0-5.0 | <5.0 |
Figura I
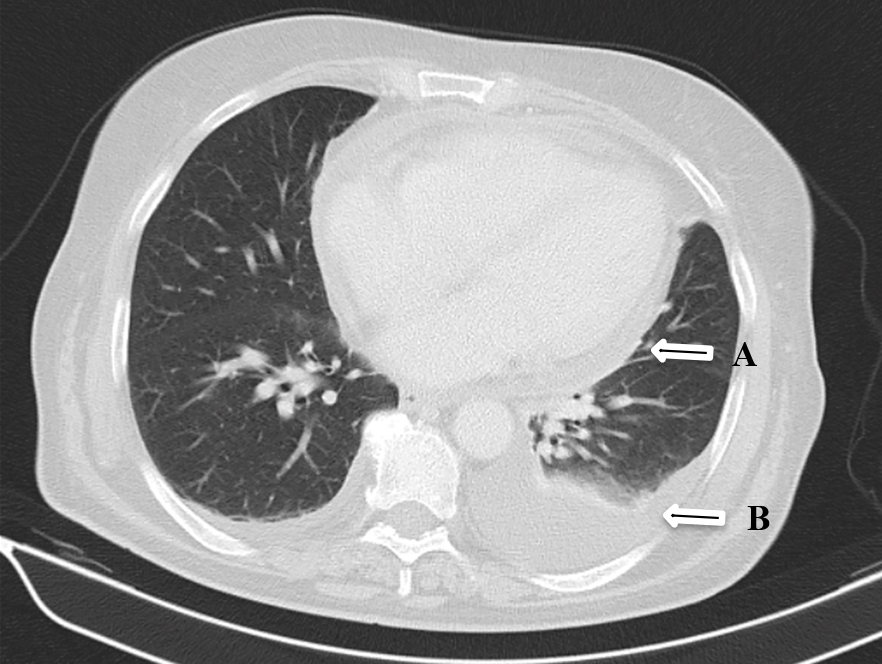
Imagem de TC de tórax; seta A – derrame pericárdico; seta B – derrame pleural
Figura II
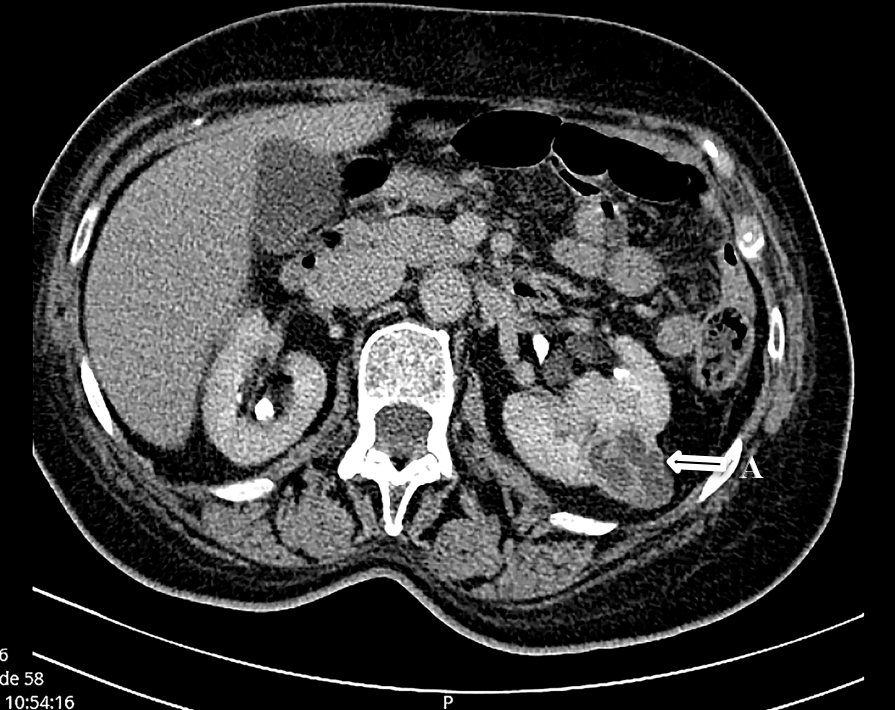
Imagem de TC abdominal; seta A – quisto renal esquerdo complexo.
Figura III
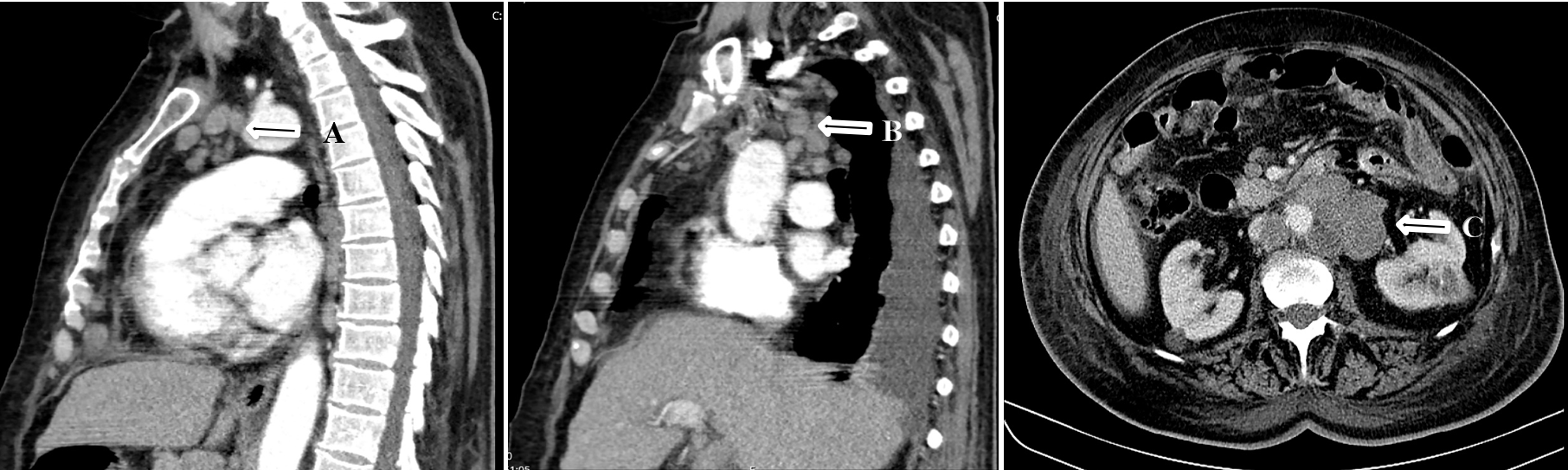
Imagens de TC de tórax e abdominal; setas A e B – conglomerado adenopático mediastínico; seta C – conglomerado adenopático peri-aórtico.
BIBLIOGRAFIA
[1] Das DK. Serous effusions in malignant lymphomas: a review. Diagn Cythopatol. 2006; 34 (5): 335-347
[2] Falcini F, Bardare M, Cidaz R, Lippi A, Corona F. Arthritis as a presenting feature of non-Hodgkin’s lymphoma. Arch Dis Child 1998; p 367–370
[3] Longo D. 105: Cânceres de células linfóides. Fauci A, Kasper D, Longo D, Loscalzo J, Braunwald E, Hauser S. Harrison Medicina Interna. Rio de Janeiro: McGraw-Hill Interamericana do Brasil, 2008. P. 687-700
[4] Gandhi S. Diffuse large cell lymphoma clinical presentation. Medscape, 2016
[5] Friedberg J, Fisher R. Difuse Large B-cell NHL. Leonard J, Coleman M. Hodgkin’s and Non-Hodgkin’s Lymphoma. Boston: Springer, 2006. p 121-140
[6] Otter R, Gerrits WB, vd Sandt MM, Hermans J, Willemze R. Primary extranodal and nodal non-Hodgkin´s lymphoma. A survey of a population-based registry. Eur J Cancer Clin Oncol 1989;25:1203–1210.
[7] Ferry J. 4th Chapter: Lymphomas of the Thorax. Ferry J. Extranodal Lymphomas. Elsevier, 2011. p 81-132
[8] Yadlapati S, Efthimiou P. Autoimmune/Inflamatory Arthritis associated Lymphomas: Who is at risk?. BioMed Research International. 2016; p 1-11

