Introdução
A Síndrome de Lemierre (SL) é uma doença rara que se manifesta como uma complicação de um processo infecioso localizado à região da cabeça e pescoço, manifestando-se por trombose séptica local (veia jugular interna) e/ou embolização séptica sistémica.1 Surge habitualmente em adolescentes ou adultos jovens saudáveis, em cenário clínico peri ou pós-amigdalite/faringite (87.1% dos casos). Menos frequentemente associa-se a infeção odontogénica, mastoidite, otite ou sinusite.2 O microorganismo mais comummente envolvido é o Fusobacterium necrophorum (bacilo Gram negativo, anaeróbio).1 O tratamento assenta na antibioterapia com cobertura anaeróbia e/ou dirigida ao agente identificado (a ser o caso). Raramente poderá ser necessária abordagem cirúrgica.2,3 A mortalidade atribuível, potencialmente subestimada por défice diagnóstico, ronda os 5%2. Constituindo um evento patológico potencialmente causador de morbilidade e mortalidade significativas, o artigo presente tem por propósito o de apresentar as particularidades diagnósticas e terapêuticas da SL, relevando a importância do estabelecimento precoce do diagnóstico e do ajustamento eventual da terapêutica antimicrobiana.
Caso Clínico
Indivíduo masculino, com 21 anos e de etnia caucasóide. Diagnóstico prévio de asma. Conhecida a alergia a penicilina. Negava consumo de drogas endovenososas, procedimentos dentários recentes, contacto com pessoas doentes ou viagens recentes.
Admitido no Serviço de Urgência por síndrome febril subagudo, associado a odinofagia e dorsalgia, negando sintomatologia adicional. Na semana precedente tinha apresentado amigdalofaringite aguda medicada em ambulatório com macrólido (azitromicina). Por ausência de resposta clínica, alterada terapêutica para lincosamida (clindamicina) e corticóide sistémico (deflazacorte), mantendo-se a refratariedade sintomática. Ao exame físico apresentava-se desidratado, febril, taquicárdico (130 bpm), hipotenso (95/56 mmHg), taquipneico (30 cpm) e com SpO2 de 94% (FiO2 28%). Avaliação cervical sem sinais inflamatórios locais e/ou adenopatias palpáveis. Auscultação pulmonar a evidenciar roncos dispersos. A investigação analítica efetuada sustentou a presença de uma síndrome inflamatória sistémica (leucócitos, 12x103/uL; PCR, 200 mg/L), documentando a existência de disfunções hematológica (plaquetas, 5.000/uL) e renal (creatinina, 2.1 mg/dL). A gasimetria (GSA) revelou acidose metabólica compensada (GSA com FiO2 28%: pH 7.36, pCO2 34, pO2 100, HCO3 17, SatO2 97%, Lactatos 1.4; razão PaO2/FiO2 357mmHg). Na tomografia computorizada (TC) torácica observaram-se várias áreas de densificação parenquimatosa pulmonar, de aspeto nodular, dispersas em toda a altura dos campos pulmonares - patologia inflamatória/infeciosa (Fig.1). Assumida sépsis com disfunção multiorgânica (SOFA score 8) com ponto de partida respiratório, tendo iniciado antibioterapia empírica com levofloxacina.
Admitido em Unidade de Nível II. Após 72 horas de internamento, mantendo febre sustentada, evidenciou agravamento clínico progressivo, em particular do ponto de vista respiratório, sem resposta a ventilação mecânica não invasiva, com razão PaO2/FiO2 mínima 119mmHg, havendo necessidade de progressão a suporte ventilatório invasivo.
Reavaliação analítica a documentar o surgimento de anemia e coagulopatia (Tabela 1). Estudo microbiológico e autoimune até então negativos (Tabela 2). Efetuada nova avaliação imagiológica (TC toracoabdominopélvica) que demonstrou infiltrados pulmonares bilaterais extensos (perfil de agravamento) e derrame pleural bilateral de moderado volume, bem como hepatomegalia homogénea ligeira e ascite de volume pequeno a moderado (Fig. 2). Toracocentese diagnóstica com franco predomínio de polimorfonucleares neutrófilos. Ecocardiograma sem evidência de vegetações ou massas intracavitárias. No despiste de complicação local, efetuada imagem tomográfica cervical com caracterização angiográfica que revelou trombose da metade superior da veia jugular interna esquerda e pequeno trombo (não oclusivo) na veia contralateral (Fig. 3). Sem evidência de complicações a nível do cateter venoso central inserido na veia subclávia esquerda, no dia prévio à realização da imagem cervical.
No dia sete de internamento identificada bacteriemia a Fusobacterium necrophorum, sendo considerado o cenário diagnóstico de SL. Ajustada terapêutica antibacteriana após 7 dias de levofloxacina, cumprindo três semanas de terapêutica antibacteriana eficaz (6 dias de meropenem e 15 dias de clindamicina) com evolução clínica favorável. Em função da persistência da trombose venosa jugular foi iniciada hipocoagulação, que cumpriu durante 2 semanas; reavaliação por ecodoppler a documentar repermeabilização venosa completa.
O doente teve alta ao 39º de internamento orientado para Consulta Externa de Medicina Interna. Sem repercussão estrutural ou funcional sequelares. Sem intercorrências 6 meses após o evento.
Discussão
A escolha criteriosa da terapêutica antimicrobiana na abordagem de infeções do trato respiratório superior, por estreitamento do espectro, tem permitido o ressurgimento de casos de SL. Não se pretende questionar o estreitamento da terapêutica antimicrobiana, que se considera adequado, mas valorizar o cenário de infeção persistente como mandatório da investigação de complicação estrutural.4
O relativo desconhecimento em que esta doença caiu, e o aparecimento recente de novos casos, sugere que esta situação clínica possa estar a ser subdiagnosticada. Apesar de retrospetivamente as características clínicas do SL serem relativamente específicas, o seu diagnóstico exige um elevado índice de suspeição.4,5
O evento índice mais frequente corresponde à faringite (envolvimento amigdalino ou periamigdalino). O agente causador mais comum é o Fusobacterium necrophorum, agente comensal presente na flora oral, digestiva e genital.1,5 Outros microorganismos potencialmente envolvidos, isoladamente ou em associação ao Fusobacterium necrophorum, são os Bacteroides, Eikenella, Streptococcus, Peptostreptococcus, Porphyromonas, Prevotella, Proteus, Staphylococcus aureus sensível à meticilina e Staphylococcus aureus resistente à meticilina.6,7 O intervalo temporal entre a infeção faríngea e a tromboflebite é, geralmente, inferior a uma semana, facto observado no caso descrito.4
O tratamento deve iniciar-se aquando da suspeita clínica, não devendo ficar pendente da caracterização microbiológica, pelo facto de o respetivo atraso ser condicionante de implicações prognósticas. No caso apresentado, o facto de estar documentada alergia à penicilina condicionou a escolha inicial da terapêutica antibacteriana empírica, facto que pode ter determinado a evolução descrita.4,8
A introdução de terapêutica hipocoagulante é controversa, e habitualmente não é aconselhada na SL devido ao risco de expansão de infeção, devendo ser reservada a casos de progressão trombótica retrógrada ao seio cavernoso.8 No caso descrito, a hipocoagulação não foi iniciada aquando do diagnóstico, sendo apenas introduzida por persistência da trombose.
Conclusão:
A SL pode condicionar morbimortalidade significativa caso não seja estabelecido, de forma precoce, o diagnóstico e otimizado o tratamento antimicrobiano específico. A não resolução/persistência de cenário infecioso deverá determinar a investigação de complicações estruturais locais e/ou à distância (trombose séptica, abcesso ou embolização séptica).8 O caso descrito é exemplificativo de uma evolução, que sendo rara, configura um cenário específico de infeção respiratória superior.
Quadro I
Estudo analítico.
| | D0 | D3 | V. Ref. |
| | | | |
| Hemoglobina (g/dL) | 13.4 | 9.3 | 13.5-17.5 |
| Leucócitos (/uL) | 12.9 | 12.7 | 4-11 |
| Neutrófilos | 12.4 | 10.7 | 1.8-8.0 |
| Linfócitos | 0.5 | 0.13 | 1.0-4.5 |
| Plaquetas (/uL) | 5 | 39 | 150-450 |
| INR | 1.3 | 1.6 | |
| aPTT (seg) | 23.5 | 24 | 30 |
| Fibrinogénio(mg/dL) | | 404 | 203-472 |
| Sódio (mmol/L) | 131 | 135 | 136-145 |
| Potássio (mmol/L) | 4.6 | 4.7 | 3.5-5.1 |
| Ureia (mg/dL) | 206 | 86 | 19-44 |
| Creatinina (mg/dL) | 2.1 | 1.0 | 0.7-1.3 |
| Bilirrubina total (mg/dL) | | 4.24 | 0.20-1.20 |
| AST/ALT (U/L) | 23/20 | 39/21 | 5-34/0-55 |
| FA (U/L) | | 137 | 40-150 |
| Gamma-GT(U/L) | | 96 | 9-36 |
| Proteínas totais (g/dL) | | 4.9 | 6.4-8.3 |
| Albumina (g/dL) | | 1.8 | 3.4-4.8 |
| PCR (mg/L) | 200 | 240 | <5.0 |
| Procalcitonina (ng/mL) | | 50 | <0.5 |
Quadro II
Estudo microbiológico e autoimune
| Microbiologia | Autoimunidade |
| | |
| Hemoculturas (aeróbios e anaeróbios). Antigénios urinários (Pneumococo e Legionella). Bacteriológico de expetoração. Chlamydia pneumoniae, Mycoplasma pneumoniae. | Velocidade de sedimentação. Ac. Anti-Nucleares, Factor Reumatóide. Ac. anti-citoplasma de neutrófilos. Ac. Anti-Cardiolipina (IgG/IgM), Ac. Anti- β2 glicoproteina I (IgG/IgM), Anticoagulante Lúpico. Ac. Membrana Basal Glomerular. C3, C4, Imunoglobulinas (G/A/M). Coombs directo e indirecto. |
| Brucella, Salmonella, Campylobacter, Borrelia burgdorferi, Rickettsia rickettsii, Leishmania, Coxiella burnetti, Leptospira, Toxoplasma gondii. TASO. IGRA, exame micobacteriológico (direto e cultural). Anticorpos anti-treponema. | |
| Vírus influenza A/B, EBV, CMV, HSV 1 e 2, Parvovírus. HIV, HAV, HBV, HCV. | |
EBV - Vírus Epstein–Barr, CMV – Vírus Citomegalovírus, HSV – Vírus Herpes Simples, TASO – Titulo Anti-estreptolisina O, HIV – Vírus da Imunodeficiência Humana, HAV/HBV/HCV - Vírus da Hepatite A, B e C, IGRA . Interferon Gamma Release Assays.
Figura I
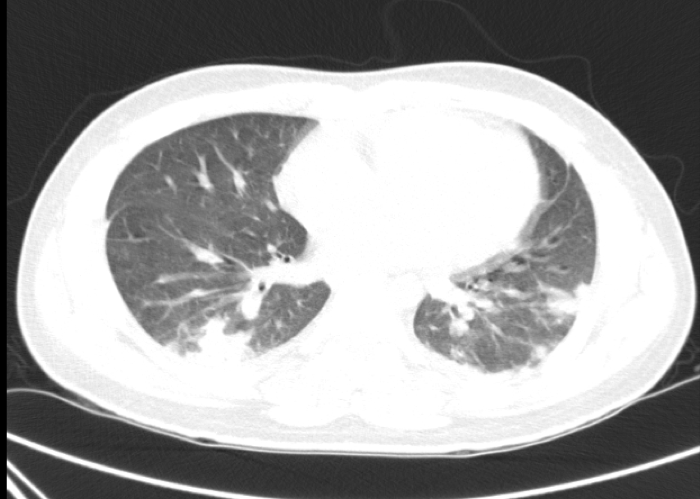
Tomografia computorizada torácica (corte axial) com áreas de densificação parenquimatosa pulmonar vagamente nodulares e fina lâmina de derrame pleural.
Figura II
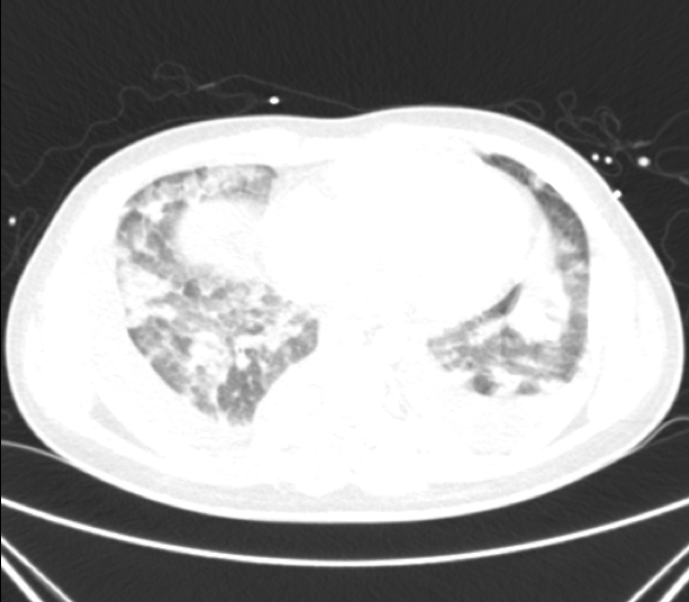
Tomografia computorizada torácica (corte axial) com extensos infiltrados pulmonares bilaterais e derrame pleural bilateral de moderado volume.
Figura III
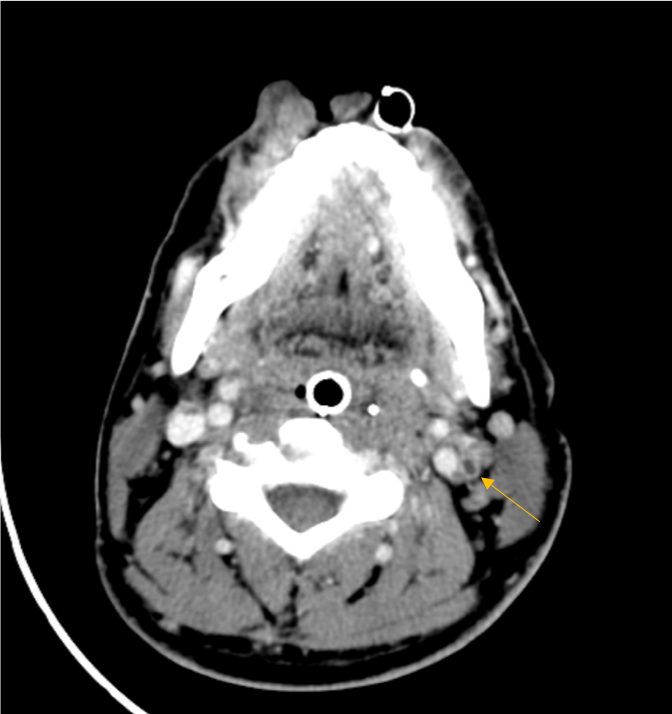
Tomografia computadorizada cervical evidenciando trombose da veia jugular interna esquerda (indicada na seta).
BIBLIOGRAFIA
1. Anthony WC, Infections of the Oral Cavity, Neck, and Head. In: Mandell, G., Douglas, R., Bennett, J., Dolin, R., Blaser, M. Mandell, Douglas, and Bennett´s principles and practice of infectious diseases. Philadelphia, Pa: Elsevier, Saunders; 2015. p. 789-805.
2. Yombi, J., Bogaert, T., Tribak, K., Danse, E. Lemierre Syndrome of the Femoral Vein, Related to Fusobacterium necrophorum Abscess of Vastus Lateralis. J Emerg Med, 2016; 50(4), e191-e193; doi: 10.1016/j.jemermed.2015.07.049.
3. Cuddy, K., Saadat, N., Khatib, B., Patel, A. Necrotizing Lip Infection Causing Septic Thrombophlebitis of the Neck: A Rare Variant of Lemierre Syndrome. J Oral Maxillofac Surg, 2018; 76(1), 134-9; doi: 10.1016/j.joms.2017.05.030.
4. Osowicki, J., Kapur, S., Phuong, L., Dobson, S. The long shadow of Lemierre’s syndrome. J Infection, 2017; 74, S47-S53. doi: 10.1016/s0163-4453(17)30191-3
5. Panchavati, P., Kar, B., Hassoun, A., Centor, R. Fusobacterium necrophorum tonsillitis with mild case of Lemierre´s syndrome. Anaerobe, 2017; 43, 102-104; doi: 10.1016/j.anaerobe.2016.12.012.
6. Ronit, C., Dennis K. Anaerobic Infections: General Concepts. In: Mandell, G., Douglas, R., Bennett, J., Dolin, R., Blaser, M. Mandell, Douglas, and Bennett´s principles and practice of infectious diseases. Philadelphia, Pa: Elsevier, Saunders; 2015. p. 2735-43.
7. Frederik V.H., Bart L., Ann V.L., Steven V. A Lemierre-like syndrome caused by Staphylococcus aureus: an emerging disease. Infectious Diseases, 2019; 1-9; doi: 10.1080/23744235.2019.1691255.
8. Johannesen, K., Bodtger, U. Lemierre’s syndrome: current perspectives on diagnosis and management. Infect Drug Resist, 2016; Volume 9, 221-7. doi: 10.2147/idr.s95050.




