Introdução
O abcesso hepático primário provocado porKlebsiella pneumoniaefoi descrito por volta de 1980, tendo-se tornado um dos principais agentes responsáveis por abcessos hepáticos adquiridos na comunidade. Apesar de ocorrer principalmente nos países asiáticos, a distribuição geográfica alterou-se, com ocorrência de casos na Europa, América do Norte e África. Alguns casos cursavam com infeção noutro órgão ou sistema, levando ao reconhecimento de uma nova entidade nosológica designada por Síndrome Invasiva por K. pneumoniae(SIKP). Esta síndrome consiste na ocorrência de abcesso hepático primário por K. pneumoniaena ausência de doença hepato-biliar subjacente com pelo menos um foco infecioso à distância.1–3
A maioria dos casos ocorre em indivíduos de ascendência asiática e em doentes diabéticos com mau controlo glicémico. No entanto, tem-se verificado a ocorrência desta síndrome em indivíduos de ascendência europeia e africana, com e sem diagnóstico de diabetes mellitus.2,3
Globalmente, a mortalidade decorrente desta síndrome é inferior às séries históricas de abcesso hepático, situando-se entre os 4% e os 11%.4,5
Não está totalmente elucidada a razão da elevada incidência da SIKP na Ásia, mas pensa-se que a elevada prevalência de colonização intestinal por estipes hipervirulentas deK. pneumoniaepossa estar relacionada.3
Caso Clínico
Apresenta-se o caso de um homem de 28 anos, de origem guineense, residente em Portugal há 3 anos, trabalhador da construção civil, com antecedentes pessoais de diabetesmellitustipo 1 sob terapêutica com insulinas glargina e lispro. Recorreu ao Serviço de Urgência por dor abdominal no hipocôndrio direito com irradiação lombar, disúria e febre com 24h de evolução. Quando examinado, o doente estava hemodinamicamente estável com temperatura timpânica 39,5ºC; auscultação cardio-pulmonar normal; abdomén indolor à palpação, sem massas ou organomegalias, sem sinal de Murphy ou dor à percussão do ângulo costo-vertebral; sem outras alterações no exame objetivo. Do estudo laboratorial, destacava-se linfopenia absoluta (270 cél/mm3), elevação da proteína C reativa (35mg/l), citocolestase hepática com hiperbilirrubinemia (AST 116UI/l, ALT 70UI/l, FA 202 UI/l, GGT 388 UI/l, bilirrubina total 1,9mg/dL com bilirrubina direta 0.71 mg/dL), sem alterações no exame sumário de urina. Telerradiografia torácica normal. Admitiu-se a hipótese de pielonefrite aguda e iniciou-se antibioterapia com amoxicilina/clavulanato (AAC) após colheita de urocultura. Após 72h, o doente estava sobreponível, mantendo-se citocolestase hepática, aumento significativo da proteína C reativa (420mg/l) com urocultura negativa, sendo então internado. Dada suspeita de foco infecioso abdominal, fez tomografia computorizada (TC) abdomino-pélvica com contraste endovenoso, que revelou coleção abcedada com 68x53mm nos segmentos hepáticos IV e V, bem como imagem de condensação pulmonar na base esquerda (Fig. 1). Foi realizada drenagem percutânea do abcesso com colocação de dreno “pigtail” e iniciada antibioterapia empírica endovenosa com piperacilina/tazobactam (PTZ) 4,5g de 8/8h e metronidazol (MTZ) 500mg de 8/8h, após colheita de produtos para exame cultural e estudo laboratorial dirigido (Tabela 2). O estudo radiológico foi complementado com TC torácica, que identificou imagens nodulares arredondadas, com broncograma áereo, pequenas áreas de cavitação, discreta densificação em vidro despolido em redor, bem como um vaso pulmonar que se dirigia para o seu interior (“feeding vessel sign”), sugestivo de traduzir embolização séptica.
Foi isolada uma estirpe de K. pneumoniaecom fenótipo hipermuco viscoso resistente à ampicilina no líquido purulento recolhido por drenagem percutânea. No entanto, optou-se por não se alterar a antibioterapia dada a boa resposta clínica, tendo o doente cumprido um total de 21 dias de antibioterapia com PTZ e 5 dias com MTZ. Não foi possível caracterização molecular da estirpe. O dreno foi retirado 48h após a sua colocação por se encontrar pouco funcionante. Para avaliação da resposta à terapêutica, foi efetuado controlo evolutivo por TC toraco-abdominal, que documentou regressão das lesões pulmonares e diminuição das dimensões do abcesso hepático (Fig. 2). O doente teve alta melhorado, orientado à consulta de Cirurgia Hepato-Biliar para controlo evolutivo. Cumpriu ainda 21 dias de AAC 875/125mg peros de 12/12h. Foi mantido seguimento nesta consulta durante um ano, com resolução completa das lesões.
Discussão
A apresentação clínica da SIKP cursa inicialmente com sintomas inespecíficos, como febre com calafrio, dor abdominal no hipocôndrio direito, náuseas e vómitos. As alterações laboratoriais mais frequentes são a leucocitose com neutrofilia, trombocitopenia, elevação da proteína C reativa e da glicemia bem como alterações nas provas de função hepática. O diagnóstico de abcesso hepático depende principalmente dos exames de imagem, sendo a tomografia computorizada (TC) mais sensível que a ecografia na sua deteção. Na maioria dos casos, os abcessos hepáticos no contexto de SIKP não estão associados a doença ou intervenções prévias das vias biliares ou intestino.6No que respeita ao diagnósticos dos êmbolos pulmonares os achados mais relevantes são a presença de nódulos associados a um vaso que se dirige ao seu interior (´eeding vessel sign´).7Relativamente ao diagnóstico microbiológico, o isolamento de uma estirpe de K. pneumoniae com fenótipo hipermuco viscoso no sangue ou em pus proveniente de abcesso hepático é muito sugestiva de se tratar de uma estirpe invasiva. Considera-se que a identificação deK. pneumoniaeno sangue de doentes diabéticos ou asiáticos deve motivar exame de imagem para exclusão de abcesso hepático.2A exposição antibiótica prévia deve ser investigada, pois, a administração de ampicilina ou amoxicilina nos 30 dias prévios aumenta o risco de SIKP.8
A infeção à distância ocorre principalmente no pulmão, no sistema nervoso central e no olho, sendo que apenas um terço dos focos extra-hepáticos faz parte da apresentação inicial (Tabela 1). De forma inversa, endoftalmite isolada aK. pneumoniae pode preceder a SIKP em doentes diabéticos. Das complicações descritas, a meningite, o abcesso cerebral, a endoftalmite, a embolização séptica pulmonar e o empiema acompanham-se de maior morbi-mortalidade.1–3
A hipervirulência das estirpes deK. pneumoniae, é conferida por alterações na síntese capsular e nos metabolismos do ferro e da alantoína. O fenótipo capsular de hipermucoviscosidade, que confere maior resistência à fagocitose, é conferido pelos serótipos capsulares K1 e K2. De igual modo, o genermpA, responsável pela regulação do fenótipo mucóide que provoca um aumento da síntese capsular, vai proteger contra a acção do sistema imunitário. A disponibilidade de ferro, essencial à homeostasia bacteriana, é potenciada pela presença do genekfu, que codifica um sistema de captação de ferro, bem como pela síntese da aerobactina, uma molécula siderófora que permite a aumentar a absorção de ferro. Finalmente, a presença do geneallS, responsável pelo aumento de síntese de alantoína, também contribui para o aumento de virulência das estirpes portadoras.6
A abordagem terapêutica da SIKP depende não só dos órgãos envolvidos, mas da também da gravidade da infeção. O controlo glicémico apertado parece diminuir a probabilidade de infeção à distância e melhorar a resposta à terapêutica. O abcesso hepático deve ser drenado o mais rapidamente possível, de preferência por via percutânea. No entanto, alguns estudos sugerem maior sobrevida nos doentes críticos com excisão do tecido hepático contendo o abcesso.1-3
A antibioterapia deve ser dirigida pelos exames culturais e pela resposta clínica ao tratamento. Dada a baixa incidência de infeções por agentes multirresistentes, considera-se que as cefalosporinas de terceira geração (C3G) ou as quinolonas constituem a antibioterapia de primeira linha. Nos casos de atingimento do SNC, devem utilizadas as C3G (ceftriaxone 2g de 12/12h ou cefotaxima até 2g de 4/4h) durante pelo menos três semanas. A endoftalmite deve ser tratada com antibioterapia por via endovenosa e intravítrea com uma combinação de uma C3G (ceftazidima) e de um aminoglicosídeo (amicacina). No caso das estirpes produtoras de beta-lactamases de espectro estendido, deve ser utilizado um carbapenemo como o imipenemo ou meropenemo, em dose ajustada ao local de infeção. A duração da antibioterapia pode variar entre as 4 semanas, no caso de abcesso hepático isolado até às 6 semanas no caso de haver vários focos infeciosos.1–3
Conclusão
Apesar de frequente nos países asiáticos, a incidência da SIKP no Ocidente é baixa, com poucos casos descritos em Portugal. A sua identificação requer uma elevada suspeição clínica e este diagnóstico deve ser equacionado em doentes diabéticos e/ou asiáticos que se apresentem com um quadro de febre sem foco. O tratamento adequado da SIKP depende da identificação do agente causal, sendo a drenagem auxiliada por método de imagem crucial ao diagnóstico e tratamento do abcesso hepático. De igual modo, deve ser imediatamente iniciada antibioterapia empírica, adequada ao contexto epidemiológico. O estudo exaustivo do intestino e vias biliares não se justifica sistematicamente, pois a maioria das infecções descritas sem alterações ou instrumentação prévia. Neste caso, dada a origem do doente, era fundamental considerar a etiologia amebiana e iniciar terapêutica com MTZ até obtenção dos resultados parasitológicos. O diagnóstico serológico de infeção amebiana deve ser sempre realizado, dada a sensibilidade por vezes baixa do exame parasitológico. Este caso também ilustra a necessidade de uma vigilância clínica mais apertada quando é identificado um abcesso hepático a K pneumoniae, particularmente em doente diabéticos, dado o risco de complicações com elevada morbi-mortalidade quando se trata de SIKP.
Finalmente, o estudo molecular e genético das estirpes é crucial para uma melhor caracterização epidemiológica desta doença infeciosa emergente, no que respeita à relação entre colonização intestinal, infeção e transmissão da SIKP, bem como o papel dos movimentos migratórios atuais no surgimento de casos no Ocidente.
Quadro I
MANIFESTAÇÕES EXTRA-HEPÁTICAS DA SÍNDROME INVASIVA A K. PNEUMONIAE
| | |
| | |
| Olho | Endoftlamite |
| | Uveíte |
| Órgãos intra-abdominais | Abcesso esplénico |
| | Abcesso prostático |
| | Abcesso renal |
| Pele e tecidos moles | Abcesso cervical |
| | Fasceíte necrotizante |
| Pulmão | Êmbolos sépticos pulmonares |
| | Empiema |
| Sistema cardio-vascular | Embolia pulmonar séptica |
| | Endocardite |
| Sistema musculo-esquelético | Artrite séptica |
| | Abcesso do psoas |
| | Osteomielite |
| Sistema nervoso central | Abcesso cerebral |
| | Abcesso epidural |
| | Meningite piogénica |
Manifestações extra-hepáticas da Síndrome invasiva a K. pneumoniae reportadas na literatura, listadas por ordem alfabética. Adaptado de (2,3).
Quadro II
ESTUDO ETIOLÓGICO COMPLEMENTAR
| | |
| | |
| Exames Culturais | |
| Sangue – exame bacteriológico | Negativo |
| Pús – exame bacteriológico | Klebsiella pneumoniae resistente à ampicilina. Fenótipo hipermucoviscoso |
| Pús – exame parasitológico | Negativo |
| Pús – exame micológico | Negativo |
| Pús – exame micobacteriológico | Negativo |
| Urina – exame bacteriológico | Negativo |
| Exames serológicos | |
| Ac anti-VIH 1/2 | Negativo |
| Ac anti-VHB | Negativo |
| Ac anti-VHC | Negativo |
| Ac anti-Echinococcus granulosus | Negativo |
| Ac anti-Entamoeba histolytica | Negativo |
| Outros exames complementares de diagnóstico | |
| Ecocardiograma transtorácico | Sem alterações |
Exames complementares de diagnóstico realizados durante a marcha diagnóstica. Ac – anticorpos; VIH – vírus da imunodeficiência humana; VHB – vírus da hepatite B; VHC – vírus da hepatite C.
Figura I
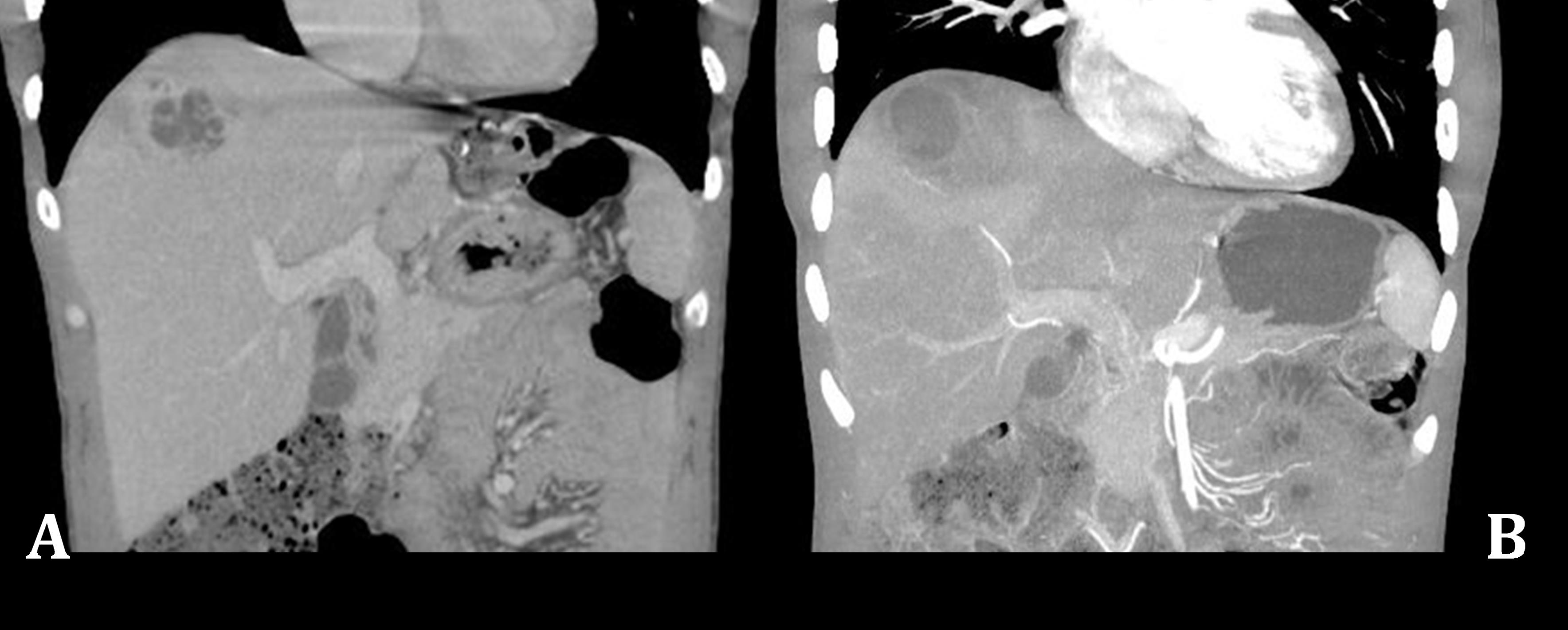
Avaliação por TC abdominal com contraste do abcesso hepático, no momento do diagnóstico (A), após drenagem percutânea e 21 dias de antibioterapia com PTZ (B).
Figura II
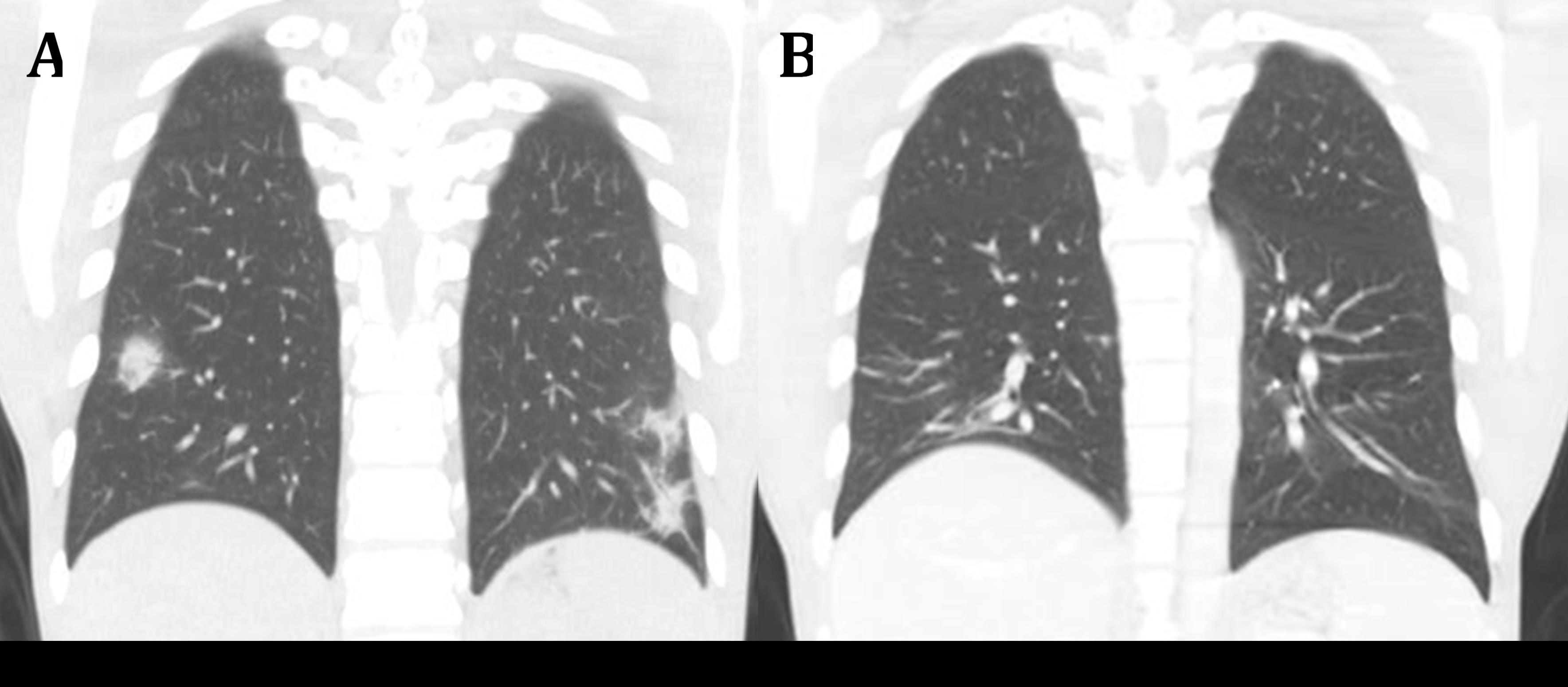
Avaliação por TC torácica, no momento do diagnóstico (A) e após 21 dias de antibioterapia com PTZ (B).
BIBLIOGRAFIA
1. Moore R, O’Shea D, Geoghegan T, Mallon PWG, Sheehan G. Community-acquired Klebsiella pneumoniae liver abscess: An emerging infection in Ireland and Europe. Infection. 2013;41(3):681–6.https://doi.org/10.1007/s15010-013-0408-0
2. Siu LK, Yeh K, Lin J, Fung C, Chang F. Klebsiella pneumoniae liver abscess : a new invasive syndrome. Lancet Infect Dis. 2012;12(11):881–7. https://doi.org/10.1016/S1473-3099(12)70205-0
3. Choby JE, Howard-Anderson J, Weiss DS. Hipervirulent Klebsiella pneumoniae - clinical and molecular perspectives. J Intern Med. 2019;1–18. https://doi.org/10.1111/joim.13007
4. Wang J, Liu Y, Lee SS, Yen M, Wang YC, Wann S, et al. Primary Liver Abscess Due to Klebsiella pneumoniae in Taiwan . Clin Infect Dis. 1998;26(6):1434–8. https://doi.org/10.1086/516369
5. Yang C, Yen C, Ho M, Wang J. Comparison of pyogenic liver abscess caused by non-Klebsiella pneumoniae and Klebsiella pneumoniae. J Microbiol Immunol Infect. 2004;37(3):176–84. https://doi.org/10.1177/0300060513487645
6. Russo TA, Marr CM. Hypervirulent Klebsiella pneumoniae . Clin Microbiol Rev. 2019;32:e00001-19. https://doi.org/10 .1128/CMR.00001-19
7.Chou DW, Wu SL, Chung KM, Han SC. Septic pulmonary embolism caused by a Klebsiella pneumoniae liver abscess: clinical characteristics, imaging findings, and clinical courses. Clinics (Sao Paulo). 2015;70(6):400-407.https://doi.org/10.6061/clinics/2015(06)03
8.Lin YT, Liu CJ, Yeh YC, Chen TJ, Fung CP. Ampicillin and amoxicillin use and the risk of Klebsiella pneumoniae liver abscess in Taiwan. J Infect Dis. 2013;208(2):211-217.https://doi.org/10.1093/infdis/jit157



