Introdução
A estrongiloidíase é uma infeção crónica causada pelo parasita intestinal Strongyloides stercoralis, maioritariamente assintomática nos indivíduos imunocompetentes. Em indivíduos imunocomprometidos pode ser grave, até mesmo fatal.1,2 O espectro de manifestações clínicas é variado, com envolvimento pulmonar, gastrointestinal e, raramente, cutâneo. A hiperinfeção – em que existe uma carga parasitária muito elevada causada por ciclos repetidos de autoinfeção – e a estrongiloidíase disseminada – em que o parasita atinge órgãos habitualmente fora do seu ciclo reprodutivo, como o coração, o fígado ou o sistema nervoso central – são as duas manifestações com maior mortalidade.1 Pode ainda ocorrer sobreinfeção bacteriana pela disrupção da mucosa digestiva, causada pelo parasita, com a possibilidade de o mesmo funcionar como transportador de microrganismos, nomeadamente de bactérias intestinais. Apesar de ser uma doença de áreas tropicais e subtropicais, a sua incidência global tem vindo a aumentar em áreas não endémicas sobretudo pelos movimentos populacionais de migrantes e refugiados.1-3 É importante considerar a presença do parasita em doentes imunodeprimidos mesmo que não residam em áreas endémicas, tendo sempre em conta que a parasitação pode ser assintomática durante um longo período de tempo, que o quadro clínico pode ser grave e que a sua deteção tardia está associada a maior carga parasitária e invasão tecidular, sendo assim menos eficaz o tratamento antiparasitário. Descrevemos um caso fatal de estrongiloidíase disseminada complicada de meningite a Enterococcus faecium num doente submetido a transplante renal, que pelo desafio diagnóstico e implicações no estabelecimento e aplicação de protocolos para a pesquisa ativa do Strongyloides stercoralis em doentes de risco, consideramos relevante.
Descrição do caso
Homem de 66 anos, caucasiano, submetido a transplante renal de dador cadáver em dezembro de 2016 por doença renal poliquística, sob imunossupressão com tacrolimus, micofenolato de mofetil (MMF) e corticoesteróides.
A biópsia protocolar ao primeiro mês pós-transplante revelou rejeição celular tipo IA, tendo sido administrados três pulsos de 500mg de metilprednisolona. Um mês depois foi internado na unidade de transplantação por quadro arrastado de dor abdominal, diarreia profusa sanguinolenta, perda ponderal, tosse seca e disfonia. Dos exames complementares destacamos coproculturas e toxinas do Clostridioides difficile negativas, mas carga viral do Citomegalovirus (CMV) no sangue de 750 000 cópias/mL. Suspendeu MMF e iniciou valganciclovir mas o agravamento clínico com depressão do estado de consciência e insuficiência respiratória tipo I levou à transferência para unidade de cuidados intensivos (UCI). À admissão na unidade estava prostrado, com lentificação psicomotora, mas sem sinais neurológicos focais ou meníngeos; temperatura timpânica de 36.7ºC, frequência cardíaca de 120bpm, frequência respiratória de 40cpm e tensão arterial de 90/60mmHg. A radiografia do tórax identificou infiltrados pulmonares bilaterais, os antigénios urinários para Legionella pneumophila e Streptococcus pneumoniae, painel de vírus respiratórios e Pneumocystis jirovecii por polymerase chain reaction (PCR) foram negativos. Admitiu-se pneumonia nosocomial e doença invasiva por CMV com colite e pneumonite. Instituiu-se terapêutica com piperacilina-tazobactam, ganciclovir e imunoglobulina anti-CMV (Megalotec ®). O estado clínico do doente agravou-se necessitando de ventilação mecânica invasiva e suporte vasopressor.
A ressonância magnética encefálica mostrou realces anómalos das meninges após administração de contraste paramagnético, nomeadamente a nível occipito-parietal bilateral. O estudo do líquor revelou 400células/µL, com predomínio de polimorfonucleares, proteínas de 221,7 mg/dL, e glicose de 99 mg/dL. Os exames microbiológico, micobacteriológico, a pesquisa de Cryptococcus neoformans e a PCR do CMV no líquor foram negativos. Assumiu-se, no entanto, meningite bacteriana e modificou-se a antibioterapia para meropenem e linezolide.
Dada a manutenção de diarreia profusa, o quadro de imunossupressão e o doente ter cumprido serviço militar em Moçambique há cerca de 40 anos, insistiu-se no exame parasitológico das fezes. Na sétima amostra de fezes identificou-se uma estrutura larvar compatível com Strongyloides stercoralis (Fig. 1).
As biópsias do cólon mostraram a presença de estruturas parasitárias larvares associadas a infiltrado inflamatório neutrofílico e eosinofílico e abcessos das criptas intestinais, confirmando o diagnóstico de colite a Srongyloides stercoralis e a CMV. O lavado bronco-alveolar e as biópsias brônquicas apresentaram também infestação parasitária, com pesquisa de CMV negativa (Fig. 2). Perante o quadro clínico de estrongiloidíase disseminada, o doente iniciou tratamento com ivermectina (15 mg/dia 200µg/Kg/dia) por via oral ao 11º dia de internamento. Por suspeita de envolvimento do sistema nervoso central (SNC) pelo parasita, repetiu-se a raquicentese com isolamento, de Enterococcus faecium e, embora o exame parasitológico fosse negativo, a PCR foi positiva para Srongyloides stercoralis. Adicionou-se albendazol (400 mg de 12h/12h) à ivermectina, pela melhor penetração no SNC. Apesar da terapêutica dirigida, e do suporte multiorgânico em UCI, o doente veio a falecer ao 34º dia de internamento. Curiosamente nunca se detetou eosinofilia nos vários hemogramas deste doente.
Discussão
O Strongyloides stercoralis é o parasita responsável pela estrongiloidíase humana. É uma infestação habitualmente assintomática, e uma das doenças tropicais mais negligenciadas.1 A prevalência atinge 60% em áreas endémicas tropicais e sub-tropicais, como África, Sudoeste Asiático e América do Sul, com estimativas de pessoas infetadas a nível global variando entre 30-100M e até 370M 2. Devido aos movimentos de migrantes e refugiados estima-se que a disseminação a áreas não endémicas seja uma realidade a ter em conta.3
A via de transmissão mais frequente é o contacto cutâneo com solo infetado (pés descalços), no entanto, o parasita pode ser transmitido sexualmente por contacto oro-anal ou pela via fecal-oral.2 A entrada do parasita (larvas filariformes) no hospedeiro ocorre por invasão da pele, migrando para o intestino delgado por duas vias: diretamente através do tecido conjuntivo e pelo ciclo “clássico” em que migram pela corrente sanguínea até aos pulmões, de onde são expectorados e deglutidos. As fêmeas do Strongyloides stercoralis permanecem no epitélio intestinal e produzem ovos que originam larvas rabditiformes, que podem ser expelidas nas fezes ou causarem autoinfeção após se transformarem na sua forma filariforme e penetrarem a mucosa intestinal ou migrarem para diferentes tecidos do hospedeiro. Este ciclo de vida (Fig. 3) justifica a duração da infeção até décadas após a aquisição do parasita, e por outro lado a síndrome de hiperinfeção, isto é, a existência dum volume parasitário superior ao habitual resultante de ciclos de autoinfeção repetidos.2 A deteção do parasita em órgãos não habituais do seu ciclo de vida (fígado, cérebro, coração, trato urinário) consubstancia o diagnóstico de estrongiloidíase disseminada, situação de elevada mortalidade.4
A infeção por Stongyloides stercoralis inclui um variado espectro de manifestações: infeção intestinal assintomática, manifestação cutânea (larva currens), síndrome de Loeffler, doença intestinal crónica caracterizada por anemia, eosinofilia, síndrome de mal-absorção e diarreia crónica, síndrome de hiperinfeção e a doença disseminada. As duas últimas apresentações estão fortemente associadas a estados de imunossupressão, infeção por HTLV-1, transplantação de órgãos e corticoterapia.3
A literatura descreve uma correlação entre a infeção sistémica por bactérias intestinais e a disseminação tecidular do Strongyloides stercoralis, provavelmente por translocação bacteriana em mucosas danificadas pelo parasita.4 De facto, a meningite associada ao Strongyloides stercoralis é causada por microrganismos incomuns, como a E. coli, K. pneumoniae e S. gallolyticus.5
O doente reportado tinha manifestações gastrintestinais, respiratórias e neurológicas graves, inicialmente atribuídas a pneumonia nosocomial, a doença invasiva por CMV e a meningite bacteriana. A estrongiloidíase disseminada é uma doença rara sendo por isso o seu diagnóstico, habitualmente, tardio, o que condiciona também o seu mau prognóstico.6 A suspeita desta infeção assentou no facto do doente ter efetuado o serviço militar em Moçambique há cerca de 40 anos, ser transplantado renal sob imunossupressão e ter efetuado um mês antes pulsos de metilprednisolona, referindo a literatura que a terapêutica com corticoides é frequentemente o trigger para a estrongiloidíase disseminada.4 A infeção transmitida pelo dador afigura-se pouco provável dada a ausência de doença no recetor do outro rim. A ausência de eosinofilia associa-se a um prognóstico mais ominoso, supostamente porque a resposta imunológica será menos competente nestes casos. A meningite a Enterococcus faecium e a deteção de DNA do parasita por PCR no líquor estão de acordo com a hipótese divulgada na literatura: a translocação bacteriana veiculada pelo parasita na sua migração para os tecidos.6
O diagnóstico de estrongiloidíase pode ser efetuado por identificação do parasita no exame direto das fezes, mas frequentemente são necessários exames repetidos pois a sensibilidade de um único encontra-se abaixo dos 30%. Os testes serológicos apresentam maior sensibilidade (superior a 95%) mas menor especificidade, devido à reação cruzada com outros parasitas, e a deteção de DNA por PCR no material fecal é uma ferramenta útil com boa especificidade e sensibilidade.7 De referir que, no nosso grupo hospitalar, este último é o método utilizado para rastreio na fase pré-transplante.
Embora a ivermectina seja o fármaco de eleição, a sua absorção intestinal nestes doentes pode estar comprometida, havendo relatos de casos bem-sucedidos recorrendo à formulação endovenosa do fármaco, reservada à medicina veterinária.4 Há autores que recomendam associar albendazol, até pela sua melhor penetração na barreia hemato-encefálica. Não existem estudos atuais que permitam avaliação epidemiométrica da prevalência da infestação autóctone. No entanto, várias áreas geográficas em Portugal constituíam reservatório desta infeção até há cerca de 50 anos, devendo lembrar a hipótese de ocorrência de casos esporádicos autóctones.8
O rastreio pré-transplante da estrongiloidíase é objeto de recomendações mundiais. Em 28 dezembro de 2018 o IPST publicou a recomendação Nº 1 de 2018 que visa normalizar a prática deste rastreio em Portugal, imediatamente implementada nos doentes propostos para transplante renal no nosso grupo hospitalar.9
ConclusãoA estrongiloidíase disseminada é uma emergência médica, mais frequente em doentes imunossuprimdos, com elevada mortalidade e cuja precocidade do diagnóstico é fundamental. Para tal é imperativo sensibilizar os profissionais e estabelecer protocolos que permitam detetar a infestação pelo parasita Strongyloides stercoralis antes do desenvolvimento de quadros de maior gravidade. O coma é uma manifestação incomum da doença disseminada, mas a presença do parasita deve ser equacionada quando há isolamento de bactérias entéricas no líquido cefalorraquidiano, como forma de disseminação oculta. Destaca-se então a necessidade de realizar uma história clínica detalhada com avaliação de contexto epidemiológico incluindo viagens e residências anteriores, valorizar a presença de eosinofilia, ter em consideração que pode não existir sintomatologia enquanto se mantiver imunocompetência e que o achado microscópico de larvas nas fezes ou noutros tecidos ou líquidos permite estabelecer o diagnóstico definitivo.
Agradecimentos: Gostaria de agradecer ao Dr. Fernando Nolasco (Diretor serviço Nefrologia do Hospital Curry Cabral) e à Dra. Helena Peres (Médica Assistente do Serviço de Microbiologia) pelo apoio na elaboração do artigo.
Figura I
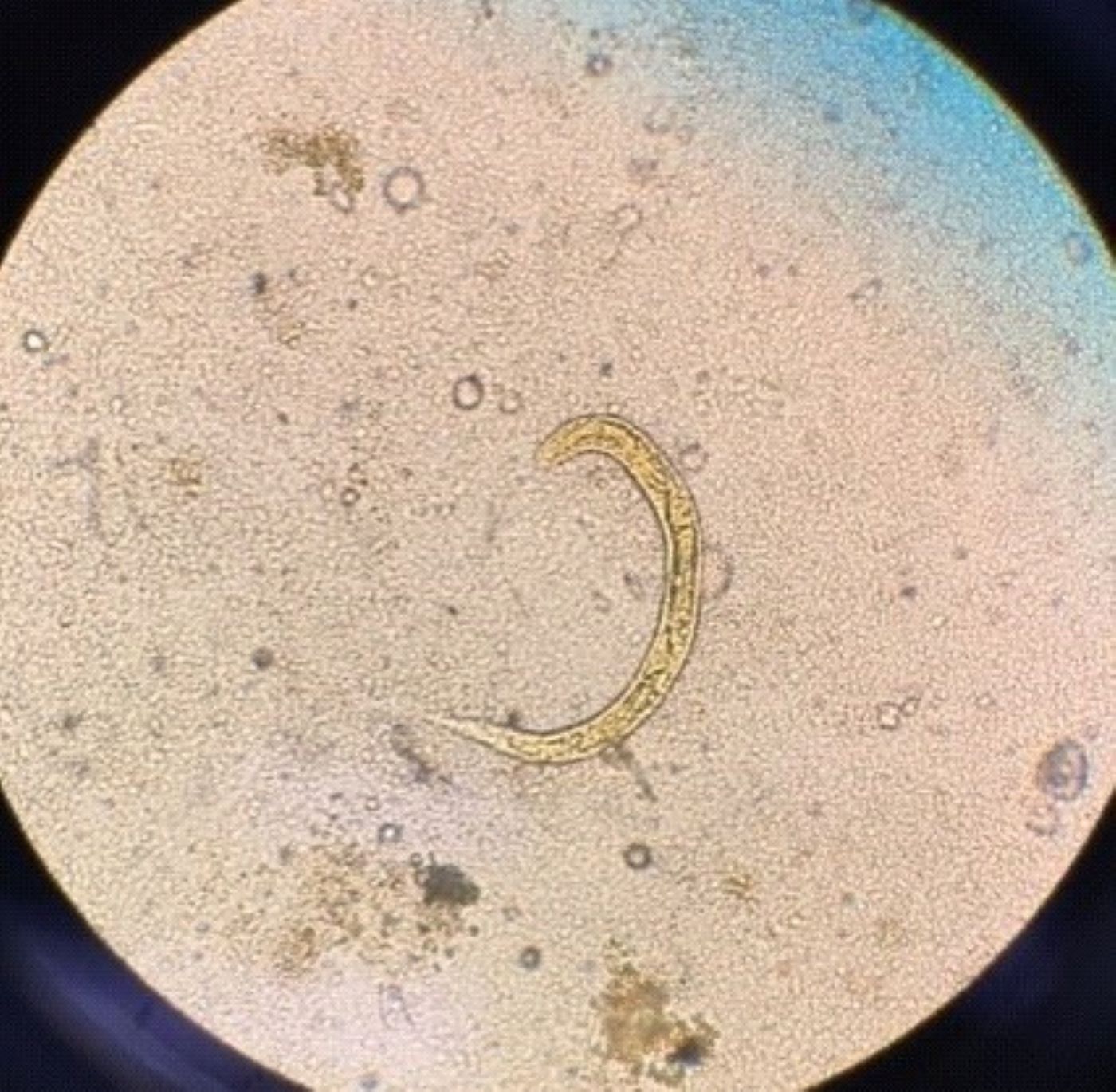
Identificação nas fezes de estrutura helmíntica compatível com Strongyloides stercoralis (técnica de concentração após centrifugação das fezes, ampliação de 100).
Figura II
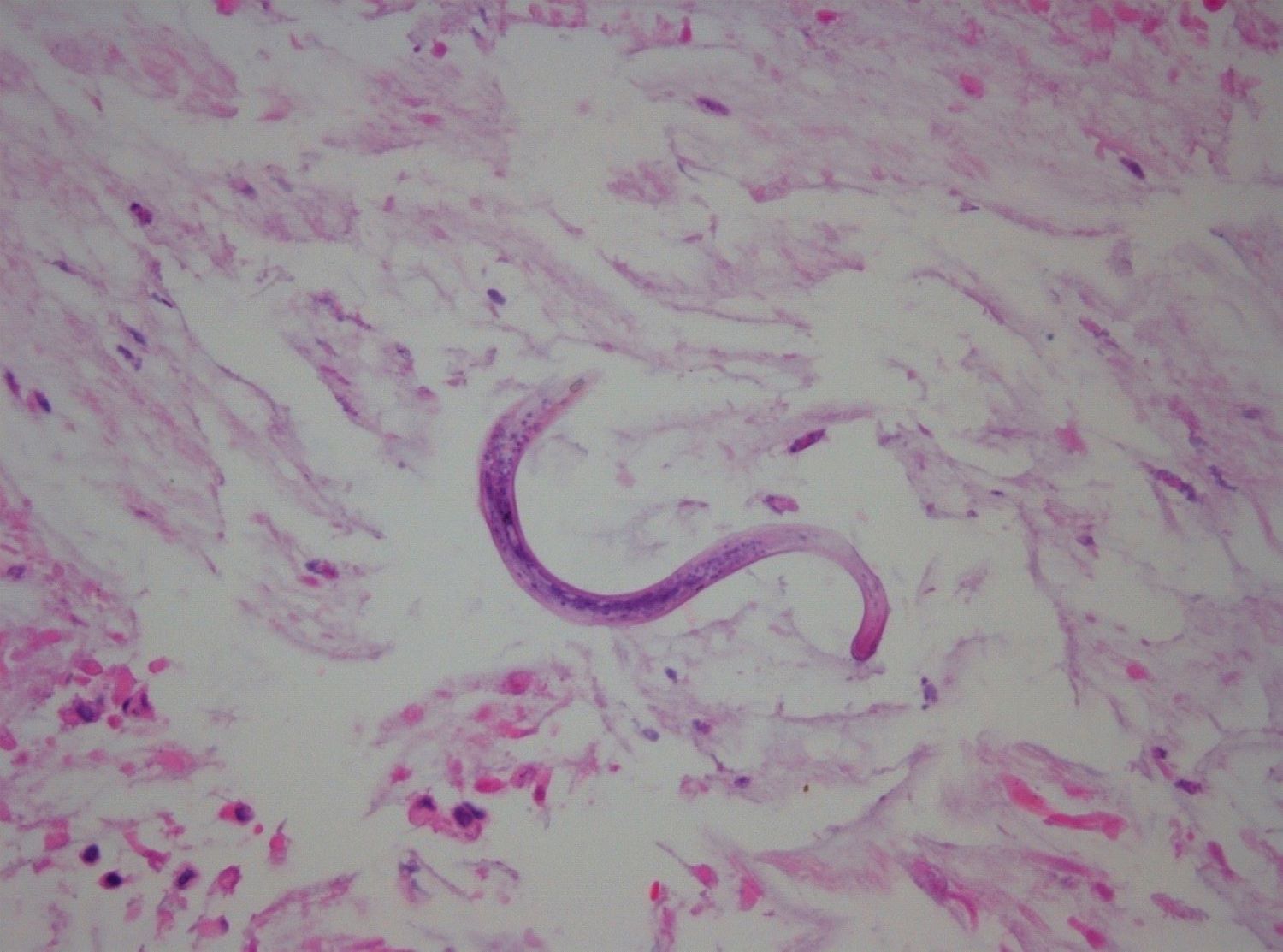
Tecido parasitário de tipo helmíntico, provável Strongyloides stercoralis em biópsia brônquica, com larvas filhas (coloração Gram).
Figura III
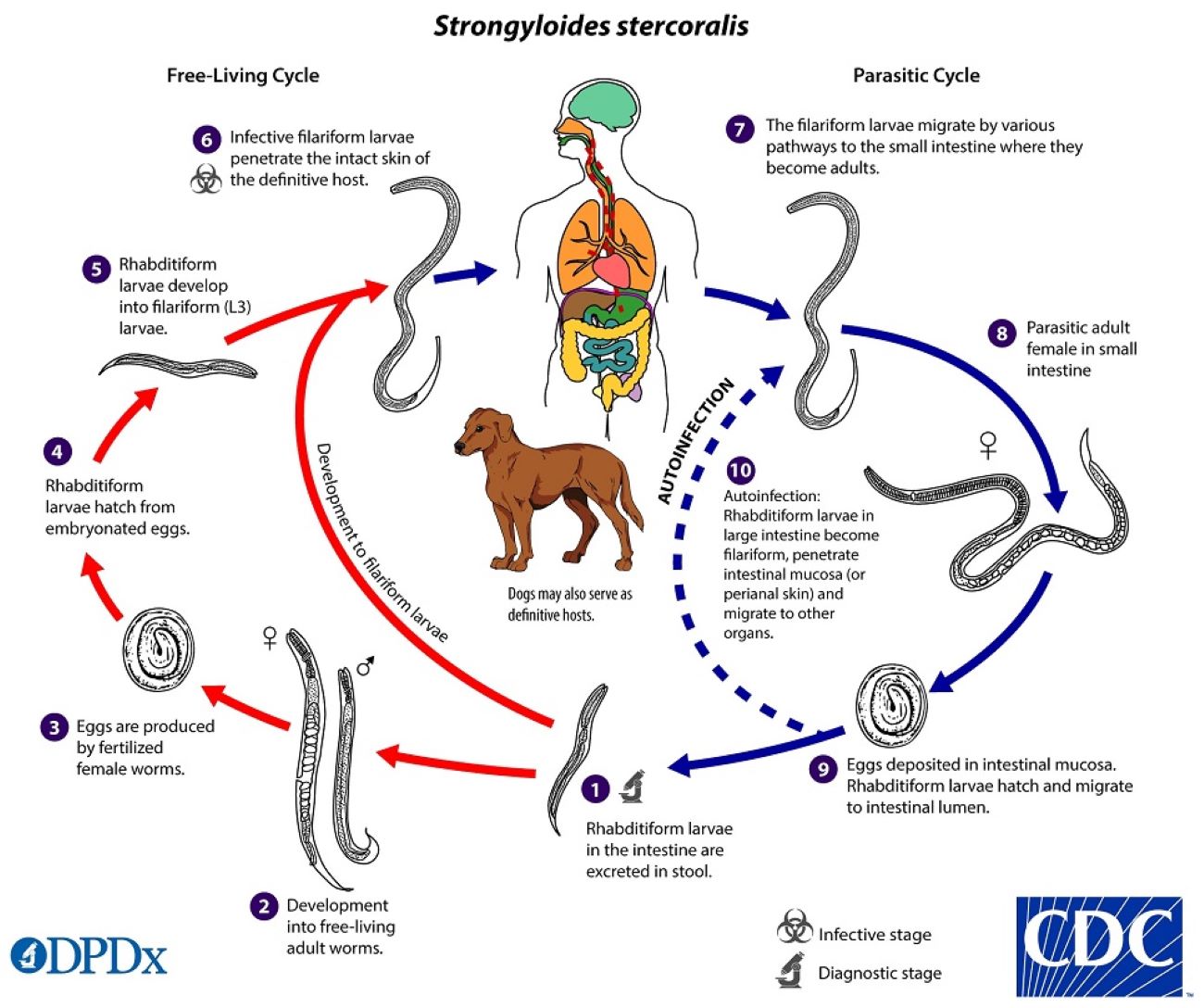
Ciclo de vida do Strongyloides stercoralis. Fonte: Centers for Disease Control and Prevention (CDC).
BIBLIOGRAFIA
1 – Keiser PB, Nutman TB. Strongyloides stercoralis in the Immunocompromised Population. Clin Microbiol Rev. 2004;17(1):208‐17. doi:10.1128/cmr.17.1.208-217.2004.
2 – Buonfrate D, Requena-Mendez A, Angheben, Muñoz J, Gobbi F, Van Den Ende J, et al. Severe strongyloidiasis: a systematic review of case reports. BMC Infect Dis. 2013; 13:78. Doi:10.1186/1471- 2334-13-78.
3 – Basile A, Simzar S, Bentow J, Antelo F, Shitabata P, Peng SK, et al. Disseminated Strongyloides stercoralis: Hyperinfection during medical immunosuppression. J Am Acad Dermatol 2010; 63:896- 902.
4 – Roxby A, Gottlieb G,Limaye A. Strongyloidiasis in Transplant Patients. Clinical Infectious Diseases. 2009; 46(9): 1411—23. Doi: 10.1086/630201.
5 – Kassalik M, Mönkemüller K. Strongyloides stercoralis hyperinfection syndrome and disseminated disease. Gastroenterol Hepatol (NY). 2011;7(11):766–8.
6 – Mukaigawara M, Masashi N, Shiiki S, Takayama Y, Takakura S.Disseminated Strongyloidiasis and Meningitis: 40-Year Experience at a Japanese Academic Medical Center. Open Forum Infectious Diseases, Volume 3, Issue suppl_1, 2016, 1183. doi: 10.1007/s15010-013-0483- 2
7- Sukhwani KS, Bansal N, Soni M, Ramamurthy A, Gopalakrishnan R. Enterococcal meningitis in association with Strongyloides hyperinfection syndrome. Germs. 2017; 7(1):28-31. doi: 10.18683/germs.2017.1105.
8 – De Morais, David. Occurrence of native strongyloidiasis in Portugal. Revista Portuguesa Doenças Infecciosas 2012; 85-92.
9 – Coordenação Nacional de Transplantação-IPST,IP. Prevenção da superinfeção por Strongyloides stercoralis na transplantação. Recomendação nº1, 2018.




