Introdução
A Estrongiloidíase é uma infeção intestinal causada por duas espécies do nemátodo Strongyloides, sendo a mais comum e de maior importância clínica o Strongyloides stercoralis. 1 Apresenta uma distribuição mundial, sendo endémica nas áreas rurais tropicais e subtropicais. 1,2,3 Uma característica distinta deste parasita é a sua capacidade de infetar e replicar-se no hospedeiro. No doente imunocompetente pode causar sintomas ligeiros, ou até mesmo permanecer assintomático, durante décadas. Por outro lado, no doente imunodeprimido pode representar uma infeção potencialmente fatal (60-85% mortalidade), através de um processo intensivo de autoinfeção – hiperinfeção/doença disseminada. Atendendo a um elevado número de migrantes e de utilização de terapêuticas imunossupressoras3,4, esta forma de doença tem vindo a aumentar, mesmo fora das áreas endémicas, devendo ser suspeitada na presença de fatores epidemiológicos e clínicos sugestivos.
Caso Clínico
Doente do sexo masculino, 52 anos, natural de Cabo Verde, a residir em Portugal há 25 anos, sem viagens recentes, com razoável grau de autonomia prévio (ECOG Performance Status de 1), com história de adenocarcinoma do pulmão estádio IV, com metástase cerebral única excisada, sob quimio e radioterapia curativas e corticoterapia em alta dose (dexametasona 12mg/dia). Foi admitido no serviço de urgência por náuseas, vómitos e dor abdominal com uma semana de evolução. Ao exame objetivo destacava-se palidez cutânea, desidratação, hipotensão (pressão arterial de 80/55mmHg) e frequência cardíaca de 115 batimentos por minuto. A salientar na avaliação analítica hemoglobina (Hb): 6.9 g/dL [valor de referência (VR): 12.0-15.0g/dL], neutrófilos: 0/µL (VR: 1.8-6.9/µL), eosinófilos: 0.0/µL (VR: <0.6/µL), plaquetas: 22.000x109/L (VR: 150-410x109/L), proteína C-reactiva 22mg/dL (VR: <0.5 mg/dL) e lactato 6 mmol/L (VR: 0.5-2.0 mmol/L). A tomografia computorizada abdominal e pélvica revelou um espessamento difuso do cólon e do íleon terminal. O doente evoluiu com choque sético com disfunção multiorgânica (neurológica, cardiovascular e hematológica), e foi por isso admitido em Unidade de Cuidados Intensivos. Foi isolada em hemoculturas Pseudomonas aeruginosa, sensível a piperacilina-tazobactam (MIC: 8 mg/L) que cumpriu durante 2 dias sem resposta clínica, motivo pelo qual foi escalada antibioticoterapia para meropenem que cumpriu durante 10 dias, com melhoria, tendo sido transferido para enfermaria de Medicina. Treze dias depois de terminar antibioterapia, iniciou quadro de hematoquézias que condicionou choque hemorrágico, com resposta a fluidos, com tempo protrombina (TP): 13.4 segundos (s) (VR: 10-14s) e INR: 1.2, tempo tromboplastina ativada (aPTT): 25.9s (VR: 20.6-29.5s), Hb mínima de 2,8 g/dL e 7.000 plaquetas, sendo a etiologia desta última admitida como mutifatorial (coagulopatia de consumo em doente sob imunossupressor e quimioterapia), com necessidade de suporte transfusional (total de 10 unidades de concentrado eritrocitário e 3 pool de plaquetas), tendo sido transferido para a Unidade de Cuidados Intermédios. O esfregaço de sangue periférico não revelou alterações das séries nem microfilaríase. Neste contexto, realizou colonoscopia que revelou úlceras profundas do cólon transverso e do cólon descendente, tendo-se visualizado larvas de Strongyloides stercoralis no exame anatomopatológico de biópsia intestinal e no exame parasitológico das fezes (Figs. 1-3). Foi iniciada terapêutica com ivermectina na dose de 15mg/dia, por via oral, com melhoria clínica progressiva e que manteve até à obtenção de 3 amostras de fezes consecutivas negativas, o que aconteceu ao 25º dia de terapêutica. Ainda durante o internamento foi identificada serologia compatível com hepatite B crónica - AgHBe positivo, ADN VHB quantificado em 1.010.000.000 UI/mL, aspartato-aminotransferase 22 U/L (VR: <40 U/L) e alanina-aminotransferase: 88 U/L (VR: <41 U/L) - pelo que iniciou terapêutica com Entecavir 0,5 mg/dia (pelo seu menor potencial de indução de nefrotoxicidade num doente sob quimioterapia, relativamente ao Tenofovir). Foi ainda realizada redução de corticoterapia ao longo do internamento, cuja suspensão ficou concluída ao 32º dia de internamento, sem intercorrências. O rastreio de VHD, VHC e VIH 1/2 foi negativo. Realizou ainda ecocardiograma transtorácico que apenas revelou regurgitação mitro-aórtica ligeira, sem outras alterações relevantes. O doente teve alta hospitalar ao 55.º dia de internamento, clinicamente melhorado e com ECOG Performance Status de 1.
Discussão
A Estrongiloidíase é uma infeção helmíntica que afeta entre 30-100 milhões de pessoas no mundo, sendo endémica nas áreas rurais das regiões tropicais e subtropicais e existindo focos de infeção noutras áreas que estão, sobretudo, associados a más condições sanitárias.1-4 O Strongyloides stercoralis e o S. fuelleborni spp. (espécies menos comuns no homem), são únicos na sua forma de infeção pois possuem um ciclo de vida complexo: um ciclo de vida livre e um ciclo parasitário, envolvendo ainda um mecanismo de autoinfecção. 1,4 A infeção ocorre geralmente por via transcutânea, sendo o local final de infecção, o intestino. Para atingir este local a larva pode migrar de duas formas: após penetração da pele ela migra até aos pulmões através do sangue e vasos linfáticos. Quando atinge o alvéolo, este é destruído pela larva, entrando assim nos brônquios, continuando a sua migração até à traqueia. Ao atingir a laringe, é deglutida, entrado no sistema digestivo, onde vai alcançar o intestino delgado.2,3 Uma outra via menos comum, é migração da larva através das vísceras abdominais e do tecido conjuntivo. No intestino delgado, a larva filariforme desenvolve-se em fêmea adulta depositando os ovos na parede do intestino que, depois de eclodirem, dão origem a larvas rabditiformes que serão libertadas nas fezes, voltando o parasita ao solo. Fora do hospedeiro, este tipo de larva dará origem a novas larvas filariformes, por via direta (desenvolvimento direto) ou indireta (reprodução sexuada de parasitas adultos) completando um ciclo de vida livre.1-4 Estas novas larvas têm capacidade para infetar um novo hospedeiro. Uma característica única do Strongyloides é que a sua forma de larva rabditiforme pode tornar-se em larva filariforme ainda no cólon, com capacidade para penetrar a parede intestinal e a mucosa anal antes de ser excretada nas fezes, sendo este o mecanismo de autoinfecção.3,5 Ainda na forma rabditiforme pode estar presente no tecido perianal, promovendo a transmissão via fecal-oral, quando associada a más condições de higiene. Este ciclo de autoinfeção pode ocorrer com um baixo número de larvas, perpetuando uma infeção crónica que, no doente imunocompetente, pode passar despercebida, através de mecanismos imunológicos e da própria biologia do parasita que acabam por regular a população de larvas no intestino. 1,2
Os doentes imunocompetentes podem desenvolver diferentes sintomas consoante o local de infecção, podendo também permanecer assintomáticos durante vários anos. Podem apresentar um rash urticariforme, serpiginoso, designado por larva currens, relacionado com a resposta inflamatória associada à migração da larva na pele.6 Tosse, sibilos e eosinofilia podem surgir no decorrer da passagem do parasita pelo sistema respiratório (Síndrome de Löffler).7 Outros doentes podem apresentar sintomas gastrointestinais, como náuseas, vómitos, dor abdominal e diarreia, quando o parasita entra no sistema gastrointestinal. Apesar da apresentação clínica poder ter formas ligeiras, ou mesmo assintomáticas, em muitos dos casos constata-se a presença de eosinofilia no hemograma.1,6
No doente imunodeprimido, pelo contrário, a apresentação desta infeção pode ser catastrófica, com uma mortalidade a atingir os 60-85%.1,2 No contexto de uma deficiente resposta imunitária do hospedeiro, uma larva fêmea adulta pode multiplicar-se intensivamente (apenas as larvas fêmeas são encontradas no Homem), dando origem a hiperinfeção ou doença disseminada.1 Estas condições ocorrem sobretudo em doentes cuja imunidade mediada por células Th2 se encontra prejudicada, como nos casos de terapêutica com corticoides ou infeção pelo HTLV-1.1,3 Outros fatores de risco associados a doença grave são as doenças oncológicas, doentes transplantados, infecção por VIH, a Diabetes mellitus e o alcoolismo.3-5 Na hiperinfeção observa-se um exuberante processo de autoinfeção, associado a elevada carga parasitária, apresentando manifestações clássicas da doença (vómitos, náuseas, diarreia, tosse, dor abdominal, hemorragia gastrointestinal).4 Simultaneamente, há um aumento da taxa de translocação bacteriana a partir do lúmen intestinal, sobretudo de agentes Gram-negativo, podendo condicionar quadros sépticos graves, como o descrito.2,7 Por seu turno, na doença disseminada, o parasita encontra-se fora dos locais tradicionais do seu ciclo de vida, podendo ser encontrado no fígado, músculo, coração ou sistema nervoso central, apresentando os doentes diferentes sintomas mediante a localização.1-4
O diagnóstico de hiperinfeção e de doença disseminada por Strongyloides requer um alto nível de suspeição, devendo ser considerada no doente imunossuprimido que, apesar de medidas apropriadas, não melhore ou apresente deterioração clínica (como no presente caso) e que o contexto epidemiológico seja sugestivo. O diagnóstico é feito através da avaliação serológica ou identificação do parasita por meio de biópsia do órgão afetado ou por exame parasitológico das fezes.1,4,7 O tratamento é feito com agentes anti-helmínticos, nitroimidazóis (ex.: albendazol) ou ivermectina oral. A ivermectina, apesar de apresentar uma taxa de cura semelhante à dos nitroimidazóis, tem menor probabilidade de causar efeitos adversos sendo atualmente considerada terapêutica de primeira linha.4, 7-10 Um doente considera-se tratado quando a pesquisa do parasita em amostras seriadas de fezes for negativa. As recomendações atuais estabelecem que doentes com risco de exposição a Strongyloides stercoralis devem realizar rastreio serológico antes do início de terapêutica imunossupressora.9,11 Devem também ser pesquisadas infeções crónicas que possam ser reativadas com a utilização de terapêutica imunossupressora, como no caso deste doente em que foi diagnosticada hepatite crónica B em fase replicativa, sob corticoterapia em dose elevada (equivalente em prednisolona superior a 15mg/dia).
Conclusão
A estrongiloidíase, endémica nas áreas tropicais e subtropicais do planeta é causada pelo Strongyloides stercoralis que possui a capacidade única de se autorreplicar – autoinfecção, perpetuando a presença do parasita no hospedeiro, condicionando uma infecção crónica. No doente imunocompetentepode permanecer assintomática durante décadas outer uma apresentação paucissintomática, tendo na doença aguda como na crónica um bom prognóstico, . No doente imunossuprimido a infecção pode ter uma apresentação catastrófica, estando associada a uma elevada taxa de mortalidade, sendo as formas graves a hiperinfecção e a doença disseminada. Estas devem ser consideradas no doente imunossuprimido que apresente quadro clínico sugestivo e contexto epidemiológico (contacto com zona endémica, não obstante o período em que ocorreu a exposição). A avaliação serológica para Strongyloides stercoralis faz parte da avaliação inicial do doente que irá iniciar terapêutica imunossupressora, sobretudo corticoterapia em altas doses, em contexto epidemiológico adequado.
Figura I
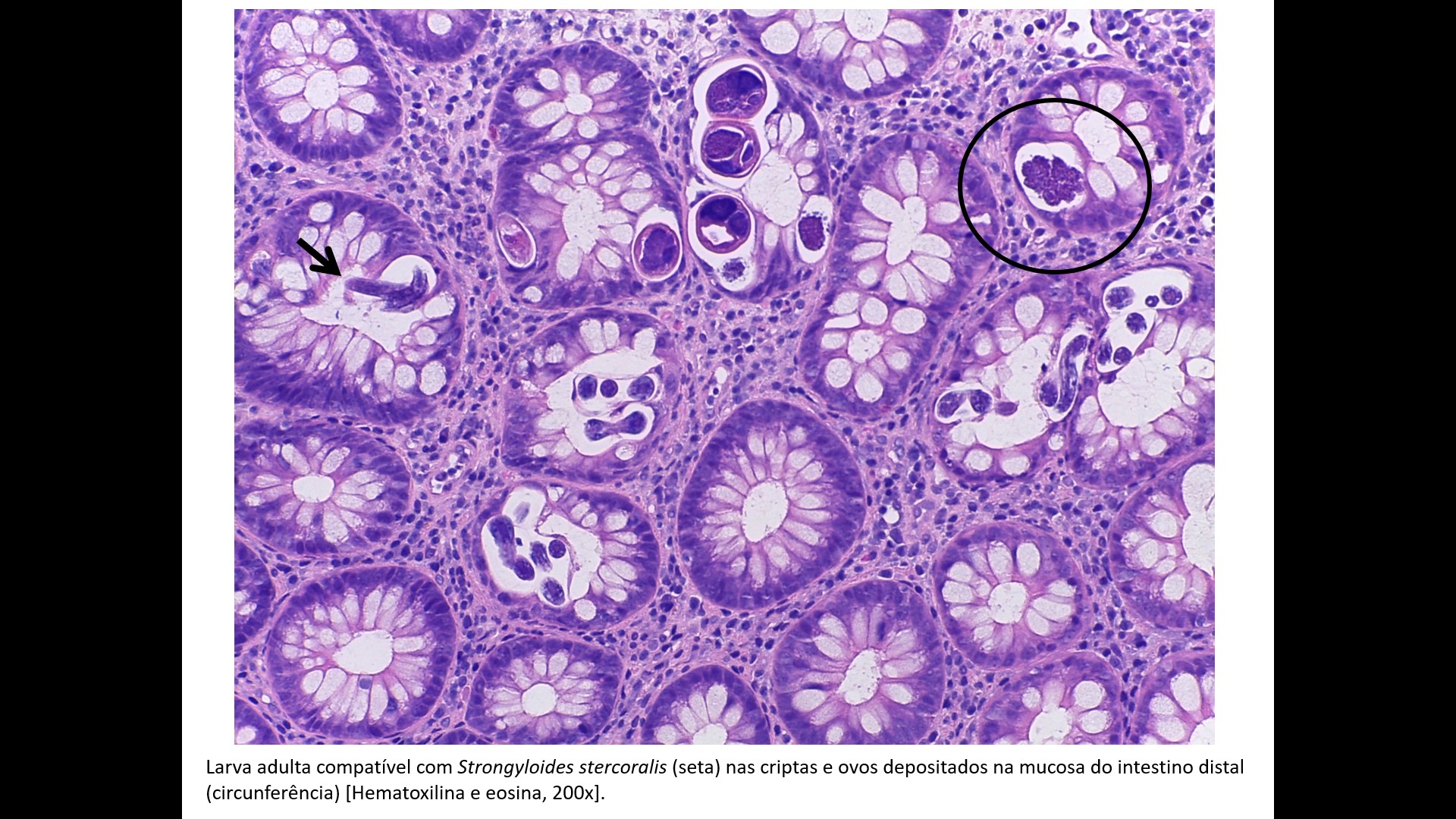
Larva adulta compatível com Strongyloides stercoralis (seta) nas criptas e ovos depositados na mucosa do intestino distal (circunferência) [Hematoxilina e eosina, 200x
Figura II
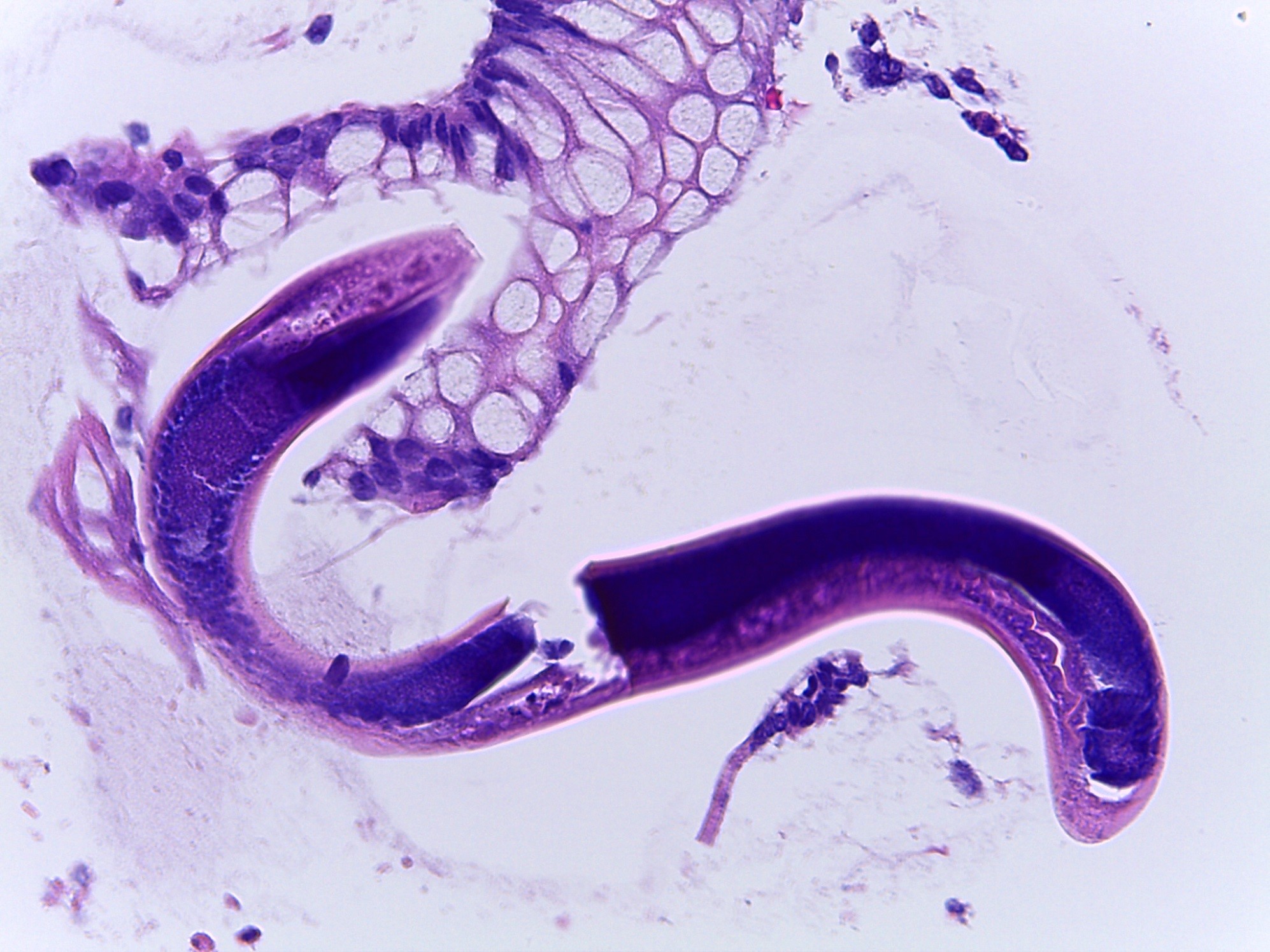
Secção longitudinal de larva adulta de Strongyloides stercoralis [Hematoxilina e eosina, 400x].
Figura III
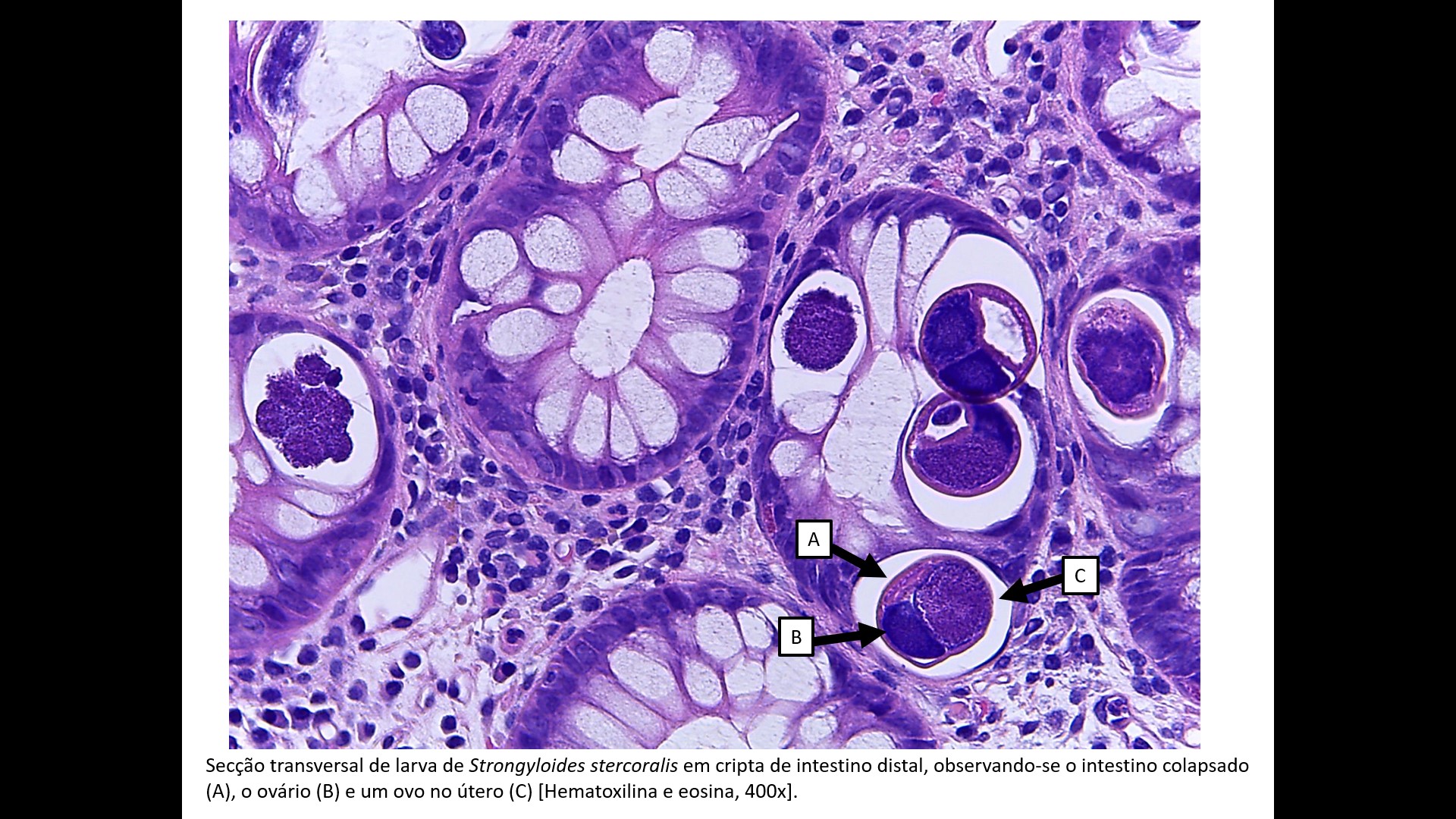
Secção transversal de larva de Strongyloides stercoralis em cripta de intestino distal, observando-se o intestino colapsado (A), o ovário (B) e um ovo no útero (C) [Hematoxilina e eosina, 400x].
BIBLIOGRAFIA
1.Nutman T. Human infection with Strongyloides stercoralis and other related Strongyloides species. Parasitology. 2016;144(3):263-73. doi:10.1017/S0031182016000834
2.Karanam L S, Basavraj G, Papireddy C. Strongyloides stercoralis Hyper infection Syndrome. Indian Journal of Surgery. 2020: 1–5. doi: 10.1007/s12262-020-02292-x
3. Vasquez-Rios G, Pineda-Reyes R, Pineda-Reyes J, Marin R, Ruiz E, Terashima A. Strongyloides stercoralis hyperinfection syndrome: a deeper understanding of a neglected disease. Journal of Parasitic Diseases. 2019;43(2):167-75. Doi: 10.1007/s12639-019-01090-x
4. Puthiyakunnon S, Boddu S, Li Y, Zhou X, Wang C, Li J et al. Strongyloidiasis—An Insight into Its Global Prevalence and Management. PLoS Neglected Tropical Diseases. 2014;8(8):e3018. doi: 10.1371/journal.pntd.0003018
5. Benincasa C, Azevedo F, Canabarro M, Valentim H, Silva V, Superti S et al. Hiper-infecção por Strongyloides Stercoralis: relato de caso. Revista Brasileira de Terapia Intensiva. 2007;19(1):128-31.
6.Feely N, Waghorn D, Dexter T, Gallen I, Chiodini P. Strongyloides stercoralis hyperinfection: difficulties in diagnosis and treatment. Anaesthesia. 2010;65(3):298-301. doi: 10.1111/j.1365-2044.2009.06196.
7. Getaz L, Da Silva-Santos L, Wolff H, Vitoria M, Serre-Delcor N, Lozano-Becerra J, et al. Persistent infectious and tropical diseases in immigrant correctional populations. Revista Española de Sanidad Penitenciaria. 2016;18(2):57-66.
8. Leder, K., Weller, P., Strongyloidiasis. Post TW, ed. UpToDate. Waltham, MA: UpToDate Inc.https://www.uptodate.com (Accessed on May 19, 2020).
9.World Gastroenterology Organization. Management of strongyloidiasis. [Internet]. Milwaukee, WI: World Gastroenterology Organization; 2018 [accessed 2020 Jun 8]. Available from: https://www.worldgastroenterology.org/guidelines/global-guidelines/management-of-strongyloidiasis/management-of-strongyloidiasis
10.Henriquez-Camacho, C., Gotuzzo, E.,Echevarria, J., White Jr., A. C.,Angelica Terashima, A.,Samalvides, F., et al. Ivermectin Versus Albendazole or Thiabendazole for Strongyloides Stercoralis Infection. Cochrane Database Syst Ver. 2016 (1):CD007745. doi: 10.1002/14651858.CD007745.pub3
11. Requena-Méndez, A., Buonfrate, D., Gomez-Junyent, J., Zammarchi, L., Bisoffi, Z., Muñoz, J. Evidence-Based Guidelines for Screening and Management of Strongyloidiasis in Non-Endemic Countries. Am J Trop Med Hyg. 2017 p7; 97(3): 645-52




