INTRODUÇÃO:
A Mielinólise Central Pontina (MCP) foi descrita pela primeira vez em 1959 numa série de casos envolvendo doentes alcoólicos com lesões desmielinizantes da ponte.1 É uma patologia rara, que integra uma entidade mais ampla (Síndrome de Desmielinização Osmótica – SDO), frequentemente associada à correção da hiponatremia, sobretudo se na presença de outras comorbilidades como o alcoolismo.2 A fisiopatologia desta síndrome parece estar relacionada com fenómenos de stress osmótico, distúrbios no metabolismo proteico entre outros mecanismos ainda não totalmente conhecidos.3,4 As manifestações clínicas são variáveis, podendo ir de casos assintomáticos, até parésia pseudobulbar, tetraparésia grave e morte. A variabilidade clínica muitas vezes atrasa o diagnóstico, o que se pode traduzir num prognóstico mais reservado.5 Os autores pretendem mostrar o caso de um doente alcoólico, sem distúrbios significativos da natremia que desenvolveu um quadro de SDO com mau prognóstico neurológico.
CASO CLÍNICO:
Homem de 67 anos de idade é internado no Serviço de Medicina Interna por Pneumonia Associada aos Cuidados de Saúde. História pessoal de internamento recente por Insuficiência Cardíaca descompensada, Miocardiopatia Dilatada, Fibrilhação Auricular, Hipertensão Arterial e Doença Hepática Crónica de etiologia alcoólica, com esteatose sem evolução para cirrose (consumo alcoólico estimado 80g/dia). Medicado cronicamente com enalapril+hidroclorotiazida 20 mg + 12,5 mg, furosemida 40mg, carvedilol 6,25 mg, amiodarona 200mg, rivaroxabano 20mg, tiaprida 100mg e oxazepam 15mg.
Na admissão encontrava-se parcialmente orientado no tempo e no espaço e colaborante; desnutrido com sarcopenia – Índice de Massa Corporal de 18,6 Kg/m2; hemodinamicamente estável; auscultação pulmonar com fervores na base pulmonar direita e auscultação cardíaca irregular, sem sopros; abdómen mole e depressível, indolor; membros inferiores sem edemas. Ao exame neurológico de realçar força muscular mantida, mas dificuldade na marcha que foi atribuída ao internamento prolongado prévio e imobilismo associado. Iniciou fisioterapia ainda nesse internamento que prosseguiu em ambulatório.
Analiticamente à entrada com leucocitose (14,400/uL), neutrofilia, Proteína C Reativa elevada (197,04 mg/L), hemoglobina 13,8 g/dl, macrocitose (VGM 108 fl), hiponatrémia discreta (sódio 132 mEq/L), potássio, cloro, cálcio, fósforo, magnésio, vitamina B12 e ácido fólico dentro dos valores da normalidade (Tabela 1).
No final da segunda semana de internamento, o doente iniciou quadro progressivo de diminuição da força muscular que culminou em tetraparésia grave [força muscular grau 3 no membro superior (MS) esquerdo; grau 4 no MS direito; grau 2 no membro inferior (MI) esquerdo; grau 3 no MI direito], atrofia muscular de predomínio esquerdo, espasticidade de predomínio nos MI, reflexos osteotendinosos presentes com hiperreflexia nos MI, e reflexo cutâneo plantar à esquerda em extensão. Denotada na avaliação dos pares cranianos, má elevação do véu do palato à esquerda, mas sem disfagia. Restantes pares cranianos sem alterações. Estado mental e funções corticais superiores preservados, sem alteração do discurso (afasia ou disartria). Sensibilidade e coordenação não alteradas. Sem distúrbios do movimento.
Do ponto de vista analítico, não se verificaram alterações significativas no hemograma com leucograma, nem na bioquímica, nomeadamente na natrémia (variação entre 132-135 mEq/L) e na caliémia (variação entre 4,3 e 5,2 mEq/L) (Tabela 1 e Gráfico 1). As serologias para Toxoplasma, Rubéola, Citomegalovírus (CMV), Epstein-Barr (EBV), grupo Herpes, Leptospira, Borrelia e Mycoplasma foram negativas. A pesquisa de serologia para o VIH (vírus da imunodeficiência humana) 1 e 2 também foi negativa.
Realizou Tomografia Computorizada (TC) Crânio-Encefálica (CE) que excluiu lesão de natureza isquémica ou expansiva bem como punção lombar, em que a análise do Líquido Cefalo-Raquídeo (LCR) citoquímica e microbiológica, não mostrou alterações.
No decurso da investigação, foi realizado Eletromiograma (EMG) para exclusão de Doença do Neurónio Motor que não revelou sinais de lesão nervosa periférica, aguda ou crónica. Neste contexto, foi pedida Ressonância Magnética (RMN) CE e cervical por hipótese de lesão demielinizante cervical alta ou pôntica, realizadas três semanas após a instalação do quadro clínico. A RMN cervical demonstrou ausência de fenómenos compressivos ou malformativos e a RMN-CE revelou hipersinal difuso em T2 a nível da ponte bem como atrofia do cerebelo muito acentuada para o grupo etário (Fig. 1).
Assim, atendendo à clínica e restantes exames complementares foi assumido o diagnóstico final de Mielinólise Central Pontina, em doente com alcoolismo e desnutrição grave que não foi submetido a correção agressiva da natrémia.
O doente realizou durante o internamento terapêutica com suporte nutricional e vitamínico, bem como reabilitação orientada pela equipa de Medicina Física e Reabilitação, tendo ingressado após a alta em Unidade de Convalescença e sido referenciado à Consulta de Neurologia. Não realizou RM-CE de reavaliação. Encontra-se em abstinência alcoólica até à data, mas perdeu alguma autonomia nas atividades da vida diária, apesar da reabilitação continuada.
DISCUSSÃO E CONCLUSÃO:
O termo MCP foi utilizado pela primeira vez em 1959 para descrever um conjunto de alterações neurológicas que ocorriam em indivíduos alcoólicos e malnutridos, associadamente a padrão típico de desmielinização confinada à ponte.1 Está englobada num conceito mais amplo – a Síndrome de Desmielinização Osmótica (SDO) – visto que, fenómenos de desmielinização associada a variações osmóticas podem afetar de modo semelhante outras regiões do cérebro.6 É uma patologia rara, frequentemente associada a hiponatremia e à sua correção. Nos últimos anos a sua incidência parece estar a aumentar, provavelmente por uma deteção mais precoce, desde que a utilização de Ressonância Magnética (RM) se foi tornando cada vez mais frequente.2
A fisiopatologia desta síndrome não é totalmente compreendida. Tradicionalmente, a sua ocorrência está relacionada com correções rápidas de hiponatremia e com fenómenos de stress osmótico. Nas hiponatremias crónicas, os mecanismos de adaptação do Sistema Nervoso Central para manter o mesmo volume celular, envolvem a perda de outros solutos intracelulares (taurina, glutamina, glutamato, entre outros), que arrastam consigo água para o compartimento extracelular, compensando a entrada de água que ocorre quando as células se vêm envolvidas por um meio hipotónico (como acontece na hiponatremia). Face a uma correção demasiado rápida da natremia, as células ficam envolvidas por um meio subitamente “hipertónico”; como a recuperação dos solutos intracelulares é mais lenta do que a correção da natremia, ocorre um perda muito acentuada de água, uma contração do volume das células, o que pode em última análise contribuir para a mielinólise.3 No entanto, este não é o único mecanismo envolvido, e fenómenos como a alteração do metabolismo proteico e disrupção da barreira hematoencefálica parecem estar igualmente envolvidos na fisiopatologia da doença.4 Por outro lado, a descrição de casos de SDO em doentes sem distúrbios ou correção rápida da natremia, aponta para a existência de outros mecanismos envolvidos e para a possibilidade que seja a variação imediata da osmolaridade (por qualquer outro soluto e não apenas o sódio) que poderá estar envolvido na fisiopatologia desta síndrome.7,8
No caso apresentado, o doente apresentava uma hiponatremia discreta, que não variou de forma significativa durante o internamento e não houve correção agressiva da mesma. De facto, a literatura sugere-nos que a SDO pode mesmo ocorrer em indivíduos com natremia normal ou elevada, mas é mais frequente em doentes com algumas comorbilidades como alcoolismo crónico, diabetes, queimaduras, sépsis, coagulopatias, insuficiência hepática ou transplante hepático, insuficiência renal, hipocaliémia, entre outros. William D. Brown afirma que a SDO ocorre num contexto clínico semelhante: um doente em risco com as comorbilidades citadas é sujeito a administração de fluidos intravenosos durante a gestão da doença subjacente. Estes doentes de maior risco apresentam distúrbios osmóticos como parte da fisiopatologia da doença subjacente e podem desenvolver a SDO.9,10
Relativamente aos exames complementares, a TC é menos sensível do que a RM na identificação das lesões de SDO ou mesmo não diagnóstica, tal como se verificou neste caso clínico. Na TC pode haver hipoatenuação na região central da ponte ou em regiões extra-pontinas, mas mesmo que se verifique não determina com precisão a extensão do fenómeno. Assim, a RM constitui-se como exame de eleição na suspeita de SDO, não só por apresentar lesões típicas de mielinólise (habitualmente simétricas, em tridente, hipointensas em T1, poupando a parte periférica da protuberância anular, e hiperintensas em T2/FLAIR), como para determinar a extensão da desmielinização e para o diagnóstico diferencial com patologia que clinica ou imagiologicamente se pode confundir com a SDO – tal como a Esclerose Múltipla, tumores ou a encefalomielite disseminada aguda. As lesões clássicas de mielinólise são visíveis em RM convencional às 2-3 semanas após a instalação dos sintomas e as RM realizadas entre 1-6 meses habitualmente refletem a recuperação clínica. 9-10
Os autores pretendem realçar com este caso clínico que a SDO não é uma patologia única e exclusiva das correções agressivas da natrémia. A apresentação clínica da MCP pode variar desde casos assintomáticos até distúrbios neuropsiquiátricos, ataxia, tetraparésia, oftalmoplegia, disfagia, disartria, coma ou síndrome Locked-in. O diagnóstico por RM apresenta lesões bem definidas, simétricas, hipointensas em T1 e hiperintensas em T2/FLAIR. Não existe tratamento específico para doentes com MPC, nem ensaios clínicos aleatorizados que o contemplem, existindo alguns reports de utilização de bólus de corticóide, imunoglobulinas, plasmaferese ou utilização dethyrotropin-releasing hormone (TRH). Assim, a melhor forma de atuar é a prevenção desta síndrome nos doentes de risco (nomeadamente na gestão da doença subjacente e na correção dos distúrbios hidroeletrolíticos) e considerar esta hipótese de diagnóstico perante quadros neurológicos semelhantes.9-11
PRÉMIOS E APRESENTAÇÕES PRÉVIAS:
O presente caso clínico foi apresentado na XXIV Reunião de Medicina Interna dos Hospitais Distritais, em novembro de 2017.
Quadro I
Controlo analítico evolutivo
| | | | |
| | D0 | D14 | Valores de referência |
| Leucócitos | 14.400/uL | 13.700/uL | 4 – 10.5 x 10^3/uL |
| Proteína C reativa | 197.04 mg/L | 59.0 mg/L | <5 mg/L |
| Velocidade de sedimentação | - | 47 mm/1h | <20 mm/h |
| Fosfatase alcalina | 149 U/L | 89 U/L | 35-104 U/L |
| Gamaglutamil transferase | 96 U/L | 50 U/L | 5 – 36 U/L |
| Creatinina | 0.9 mg/dl | 0.8 mg/dl | 0.5 – 0.9 mg/dL |
| Sódio | 132 mEq/L | 135 mEq/L | 135 - 145 mEq/L |
| Potássio | 5.2 mEq/L | 4.6 mEq/L | 3.5 – 5.1 mEq/L |
| Cloro | 101 mEq/L | 103 mEq/L | 96 – 107 mEq/L |
| Cálcio | 9.7 mg/dL | 9.4 mg/dL | 8.4 – 9.7 mg/dL |
| Fósforo | 3,9mg/dl | 4,2mg/dl | 3,0-4,5mg/dl |
| Magnésio | 1,6mEq/L | 1,7mEq/L | 1,5-2mEq/L |
| Creatinofosfoquinase | 87U/L | 89 U/L | 25-90U/L |
D: Dia de internamento
Figura I
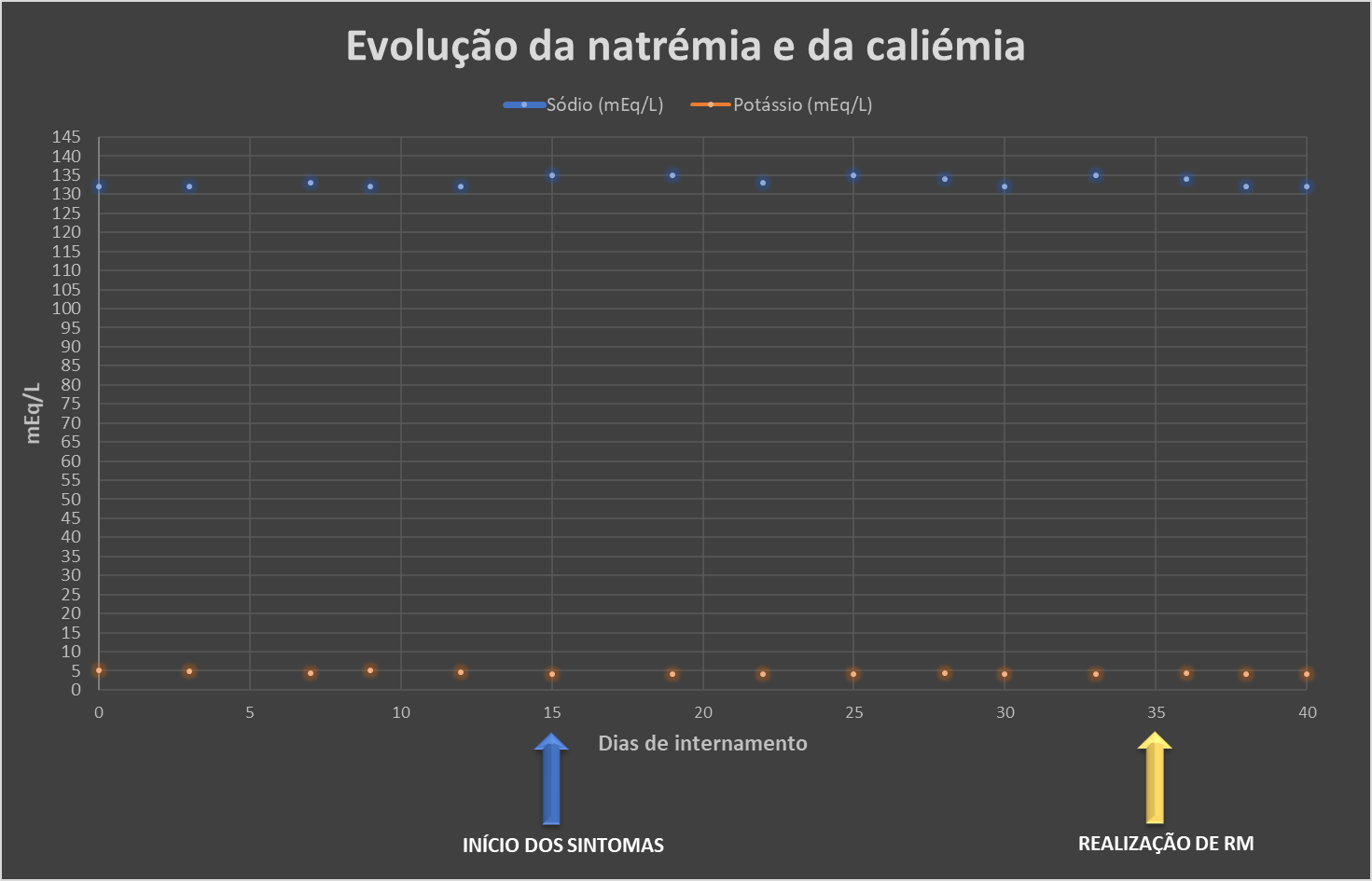
Gráfico 1 - Evolução da natrémia e da caliémia ao longo do internamento
Figura I
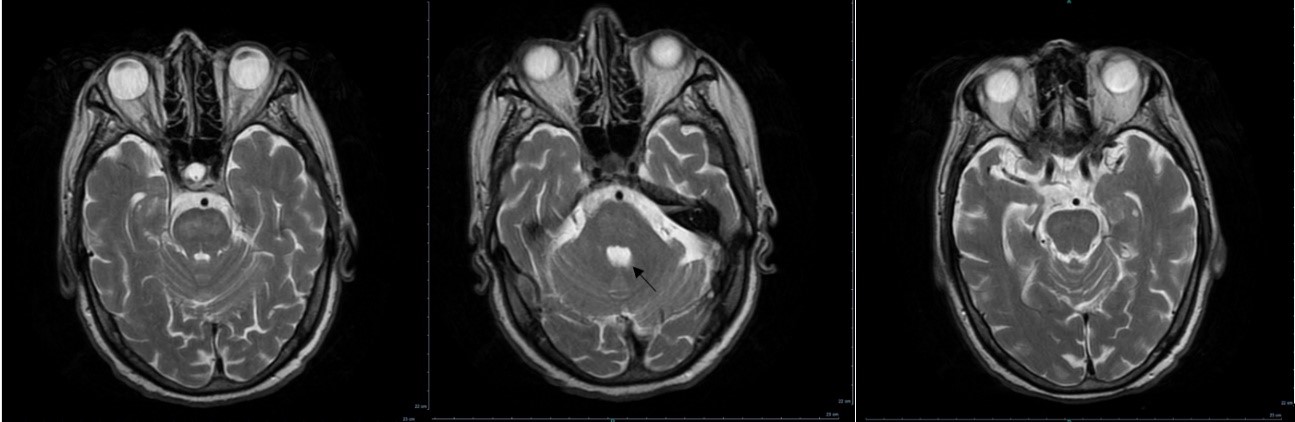
Sequências FLAIR de RM, corte axial – hipersinal na ponte, triangular, característica da Mielinólise Central Pontina
Figura II
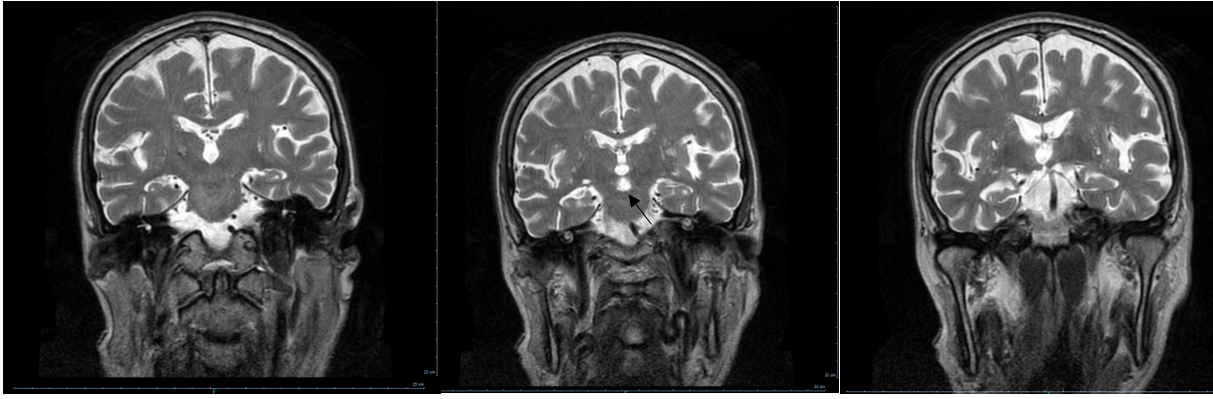
Sequências T2 de RM, corte coronal – hipersinal na ponte, bem circunscrito e triangular, característica da Mielinólise Central Pontina
BIBLIOGRAFIA
1. King JD, Rosner MH. Osmotic Demyelination Syndrome. Am J Med Sci. 2010;339(6):561–7. doi: 10.1097/MAJ.0b013e3181d3cd78
2. Aegisdottir H, Cooray C, Wirdefeldt K, Piehl F, Sveinsson O. Incidence of osmotic demyelination syndrome in Sweden : A nationwide study. Acta Neurol Scand. 2019 Nov;140(5):342-9. doi: 10.1111/ane.13150
3. Lambeck J, Hieber M, Dreßing A, Niesen W. Central Pontine Myelinosis and Osmotic Demyelination Syndrome. Dtsch Arztebl Int.2019 Sep 2;116(35-36):600-06. doi: 10.3238/arztebl.2019.0600.
4. Wang Y, Parpura V. Astroglial Modulation of Hydromineral Balance and Cerebral Edema. Front Mol Neurosci. 2018;d(June):1–18. doi: 10.3389/fnmol.2018.00204.
5. Singh TD, Fugate JE, Rabinstein AA. Central pontine and extrapontine myelinolysis : a systematic review. Eur J Neurol. 2014;1–8. doi: 10.1111/ene.12571.
6. Nicaise C, Marneffe C, Bouchat J. Osmotic Demyelination: From an Oligodendrocyte to an Astrocyte Perspective. Int J Mol Sci.2019 Mar 5;20(5):1124. doi: 10.3390/ijms20051124.
7. Fasano A, Nichelli P. Central pontine myelinolysis and poorly controlled diabetes : MRI ’ s hints for pathogenesis. Neurol Sci.2017;2–4. doi: 10.1007/s10072-017-3117-0.
8. Pliquett RU, Noll A, Ibe R, Katz A, Ackmann C, Schreiber A, et al. Hyperglycemia-related central pontine demyelinization after a binge-eating attack in a patient with type-2 diabetes : a case report. BMC Endocr Disord. 2018;1–5. doi: 10.1186/s12902-018-0245-3.
9. W D Brown. Osmotic Demyelination Disorders: Central Pontine and Extrapontine Myelinolysis. Curr Opin Neurol. 2000 Dec;13(6):691-7. doi: 10.1097/00019052-200012000-00014. doi: 10.1097/00019052-200012000-00014.
10. Kumar S, Fowler M, Gonzalez-Toledo E, Jaffe S. Central Pontine Myelinolysis, an Update. Neurol Res. 2006 Apr;28(3):360-6. doi: 10.1179/016164106X110346.
11. Lampl C, Yazdi K. Central Pontine Myelinolysis. Eur Neurol. 2002;47(1):3-10. doi: 10.1159/000047939.




