Introdução
O défice de vitamina B12 é uma causa rara de anemia hemolítica nos países ocidentais, no entanto esta etiologia deve ser tida em em conta quando nos deparamos com um caso como o descrito. Estima-se uma prevalência de 1,5% de casos de anemia hemolítica na presença de deficiência de vitamina B12.1 A marcha diagnóstica para a exclusão de todas as possíveis causas de deficiência deste hematínico deve ser exaustiva.
Descrição do caso
Um homem de 38 anos recorreu ao Serviço de Urgência com uma história de astenia e dispneia para esforços com um mês de evolução. Trabalhava numa fábrica em esquema de turnos rotativos, inclusivamente noturnos, referindo, como tal, astenia frequente. Contudo, a mesma agravou durante esse último mês. Devido à sua carga laboral, em média ingeria apenas uma refeição completa por dia, sendo as restantes escassas e em horários irregulares. Desconheciam-se doenças prévias, medicação habitual ou uso de substâncias de abuso. Vivia sozinho, sem exposição a animais ou substâncias tóxicas. Referia consumo exclusivo de água canalizada.
Negava perda de peso, febre, palpitações, ortopneia, tosse, expectoração, toracalgia, história de perdas hemáticas ou outros sintomas. Negava parestesias, défices sensoriomotores ou outros do foro neurológico. Negava episódios prévios semelhantes.
Ao exame físico destacava-se uma marcada palidez cutâneo-mucosa, assim como uma aparência envelhecida face à idade real. As escleróticas encontravam-se ictéricas e foi calculado um índice de massa corporal de 17,56kg/m2(peso 55Kg; altura 1,77 m). Os sinais vitais eram os seguintes: pressão arterial de 124/64mmHg, frequência cardíaca de 115 batimentos por minuto, temperatura de 36,0ºC e saturação periférica de oxigénio de 99% em ar ambiente. A veia jugular encontrava-se colapsada e não se verificava refluxo abdomino-jugular. As auscultações cardíaca e pulmonar não apresentavam alterações e ao exame abdominal o limite inferior do fígado era palpável 1 centímetro abaixo da grade costal. Não se verificavam alterações ao exame rectal e genital, assim como não se evidenciavam edemas periféricos. O exame neurológico era normal.
Solicitou-se radiografia torácica, análise sumária de urina e eletrocardiograma, que se revelaram normais.
Analiticamente (tabela 1) verificava-se anemia macrocítica (3.7g/dL, VGM 114.9fL) e trombocitopenia (101 000/mm3). O índice reticulocitário era de 1.9%. A contagem leucocitária (7 900/uL) e o estudo de coagulação não revelavam alterações. O esfregaço de sangue periférico apresentava anisocitose, esquizócitos e raros dacriócitos. Um défice sérico de vitamina B12 foi objectivado (<60pg/mL). Os níveis de ácido fólico e a cinética de ferro encontravam-se normais. Concomitantemente, objectivou-se hiperbilirrubinemia indirecta (bilirrubina total 2.58mg/dL; bilirrubina directa 0.44mg/dL), bem como elevação franca de lactato desidrogenase sérica (9 502 U/L) e consumo de haptoglobulina (<1 mg/dL). Os níveis de proteína C reactiva eram normais e os testes de Coombs directo e indirecto eram ambos negativos. A função renal e estudo de coagulação não revelavam alterações.
A ecografia abdominal revelava hepatomegalia (diâmetro máximo de 19 cm) e esplenomegalia homogénea (13,8 cm de diâmetro), tendo os referidos achados sido confirmados por tomografia computorizada. Não foram detectadas alterações ao nível torácico ou pélvico na tomografia computorizada.
O doente foi internado para realizar exploração diagnóstica complementar.
Foi iniciada cianocobalamina intramuscular, 1000mcg por dia nos primeiros 7 dias. Manteve-se posteriormente uma dose de 1000mcg semanais durante 4 semanas.
Do restante estudo, a electroforese de proteínas de soro, imunofixação sérica, assim como o doseamento de cadeias leves livres séricas e urinárias eram normais. A função tiroideia e painel imunológico (anti-dsDNA, ANA, ANCA, ASCA, anti-transglutaminase, anti-endomísio, anti-factor intrínseco e anti-células parietais) não revelava alterações. Não se verificou consumo de complemento. A pesquisa de clones de hemoglobinúria paroxística noturna foi negativa.
A endoscopia digestiva alta revelou gastrite atrófica antral, sem isolamento de Helicobacter pylori. A colonoscopia apresentava ulceração da válvula ileocecal, com padrão histológico inespecífico. A videocápsula não revelou alterações. Os exames microbiológicos e parasitológicos de fezes foram negativos.
Após início de suplementação com cianocobalamina intramuscular, as contagens celulares apresentaram melhoria gradual. Verificou-se um ganho ponderal de 5 kg após início de dieta diversificada em internamento.
À data de alta, o doente encontrava-se assintomático, com recuperação das linhagens hematológicas (10,4g/dL de hemoglobina; 732 000/mm3plaquetas) e uma progressiva normalização dos parâmetros de hemólise (Tabela 2).
O doente foi reavaliado em Consulta Externa de Medicina Interna dois meses mais tarde. Apresentava um ganho ponderal total de 10Kg. Regressou à sua atividade laboral e manteve uma dieta diversificada e adequada. Após cerca de 9 meses de suplementação, a terapêutica com cianocobalamina foi suspensa e o doente teve alta da Consulta Externa.
Discussão
Numa fase inicial foram consideradas algumas das principais causas de anemia em indivíduos jovens, nomeadamente as associadas a doença imunomediada, eritropoiese ineficaz bem como manifestação paraneoplásica.
Rapidamente foi identificada uma deficiência de cianocobalamina, associada a um padrão hemolítico microangiopático (hiperbilirrubinemia, elevação de LDH, consumo de haptoglobulina e presença de esquizócitos). Tanto os testes de Coombs directo como indirecto, assim como a imunologia sérica eram normais. Estes achados em associação com as alterações inespecíficas dos estudos endoscópicos digestivos levaram à exclusão de causas de anemia megaloblástica malabsorptiva, tais como a anemia perniciosa e a doença inflamatória intestinal. Contudo, as referidas alterações histológicas a nível gástrico e ileocecal foram discutidas com Anatomia Patológica. A atrofia verificada a nível do antro não se revelou típica de anemia perniciosa (onde ocorre infiltrado linfocitário do fundo e corpo do estômago, com destruição mediada por auto-anticorpos das células parietais, poupando o antro),2 mas sim de infecção por Helicobacter pylori, etiologia medicamentosa ou etilismo,3 que se revelaram negativos no contexto descrito. Relativamente à ulceração da válvula ileocecal, na sua vertente cecal, esta surgia isoladamente, sem afectação do cólon, da vertente ileal ou do íleo terminal, e sem atipias típicas de Doença Inflamatória Intestinal. Foi assumida por Anatomia Patológica eventual interferência medicamentosa/ secundária à preparação para exame endoscópico ou mesmo intercorrência infeciosa, que no contexto clínico em causa foi excluída. Por esta razão realizou videocápsula, sendo que a mesma já não revelou as alterações encontradas anteriormente. Ainda assim por estes poderem ser achados precoces de uma doença maior, e atendendo à idade do doente, mesmo na ausência de evidência serológica ou clínica de Doença Inflamatória Intestinal, a mesma carece de pesquisa activa ao longo dos anos. O doente foi orientado para os Cuidados de Saúde Primários com indicação para manter vigilância clínica activa, nomeadamente, com reavaliação analítica anual (hemograma e doseamentos de hematínicos), bem como eventual repetição de estudos endoscópicos no caso de ressurgirem alterações.
Os achados previamente descritos, em conjunto com a normalidade da electroforese de proteínas séricas, imunofixação e normalidade do estudo imagiológico (com exceção da hepatoesplenomegalia), contribuíram para a exclusão de doença linfoproliferativa e outras etiologias neoplásicas.
A rápida resposta clínica e analítica à suplementação com cianocobalamina reforçou a hipótese de anemia hemolítica secundária a eritropoiese ineficaz no contexto de deficiência de vitamina B12.
De facto, as anemias megaloblásticas são secundárias a eritropoiese ineficaz. Geralmente são causadas por défices de ácido fólico ou cianocobalamina, bem como por causas menos frequentes, tais como defeitos genéticos ou adquiridos do metabolismo destes hematínicos ou mesmo defeitos na síntese de DNA.4
Nos países ocidentais, o défice de vitamina B12 é um diagnóstico relativamente comum, em particular nas populações idosas. Numa coorte americana (National Health and Nutrition Examination Surveys), a sua prevalência foi estimada em menos de 3% em indivíduos com idades entre os 20 e os 39 anos, 4% entre os 40 e os 59 anos e de 6% naqueles com mais de 70 anos.5Em países europeus, escasseiam dados e os estudos centram-se tendencialmente em populações idosas.
A cobalamina é exclusivamente sintetizada por microorganismos, pelo que a espécie humana apenas a obtém a partir de fontes animais (carne, peixe, lacticínios) ou alimentos enriquecidos com a mesma (cereais, suplementos alimentares).6De acordo com várias publicações, as necessidades diárias variam entre 2 a 5mg,7sendo em média 3 a 30mg de cobalamina obtidas diariamente na dieta habitual.8
Geralmente, este défice deve-se a malabsorção ou aporte dietético inadequado.
Este caso reporta esta última realidade. Geralmente, a anemia e pancitopenia por défice de cianobolamina ocorrem secundariamente à presença de anticorpos contra células parietais ou factor intrínseco,4sendo aqui reportado um caso de anemia na ausência de etiologia perniciosa. Neste caso, o componente de hemólise microangiopática surge por eritropoiese ineficaz e concomitante destruição da série eritroide a nível intramedular, sendo raros os casos reportados na literatura.9
O diagnóstico final requer sempre da parte do clínico um elevado grau de suspeição, assim como a exclusão de todas as outras causas. Uma vez firmado o diagnóstico, a suplementação com cianocobalamina torna-se urgente. Para além dos sintomas de astenia e dispneia, este tipo de anemia associa-se a sintomas neuropsiquiátricos, como sejam distúrbios sensoriomotores ou mesmo disfunção cognitiva.8,10 Uma vez que estes mesmos sintomas também se verificam nos casos de défice de folatos, este último deve ser sempre excluído. A suplementação isolada com cianocoabalamina pode agravar os sintomas associados ao défice de folatos.11-14
Conclusão
Este caso destaca uma associação entre o défice de cianocobalamina e um padrão de anemia hemolítica microangiopática, na ausência de fenómenos imunomediados, como seja a anemia perniciosa. Um elevado grau de suspeição na presença desta associação, assim como uma pronta correção deste défice nutricional são fundamentais.
Figura I
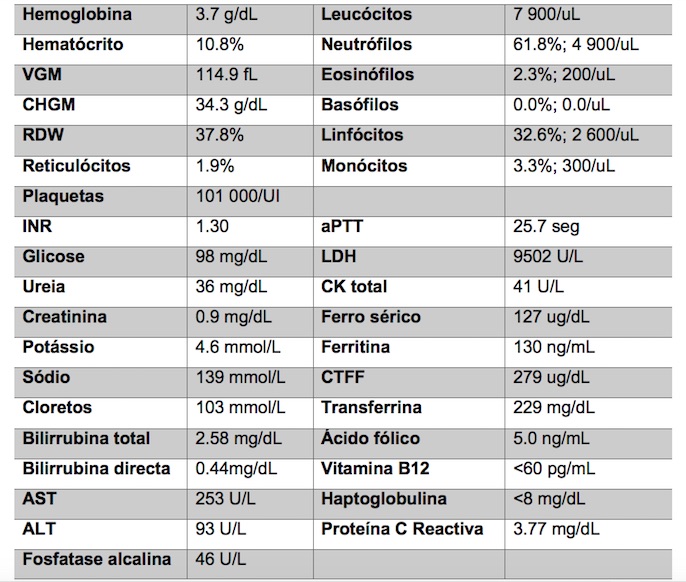
Tabela 1- Estudo analítico à admissão no Serviço de Urgência
Figura II
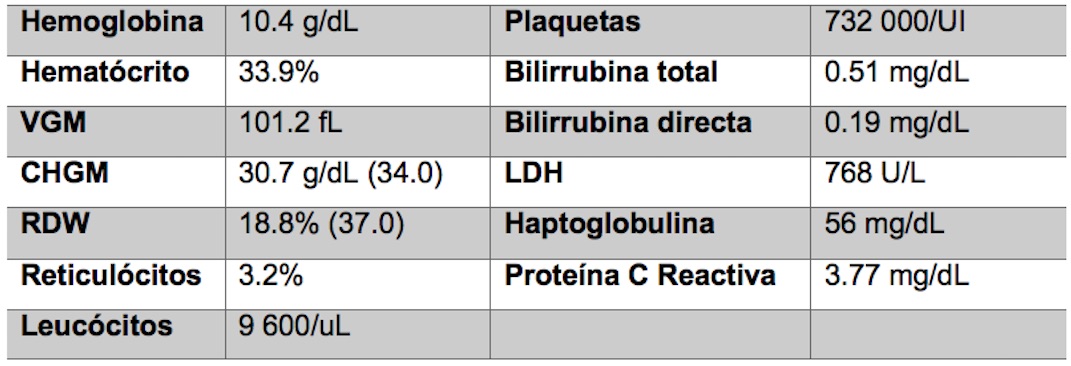
Tabela 2- Estudo analítico à data de alta clínica
BIBLIOGRAFIA
1. Andrès E, Affenberger S, Zimmer J, Vinzio S, Grosu D, Pistol G, et al. Current hematological findings in cobalamin deficiency. A study of 201 consecutive patients with documented cobalamin deficiency. Clin Lab Haematol [Internet]. 2006 Feb;28(1):50-6.
2. Strickland RG, Mackay IR. A reappraisal of the nature and significance of chronic atrophic gastritis. Am J Dig Dis [Internet]. 1973 May;18(5):426-40.
3. Dholakia KR, Dharmarajan TS, Yadav D, Oiseth S, Norkus EP, Pitchumoni CS. Vitamin B12 deficiency and gastric histopathology in older patients.World J Gastroenterol [Internet]. 2005;11(45):7078-7083.
4. Jameson, J. L., Kasper, D. L., Longo, D. L. 1., Fauci, A. S., Hauser, S. L., & Loscalzo J. Harrison’s Principles of Internal Medicine. 20th editi. Education., New York: McGraw-Hill; 2018. p. 698–708.
5. Pfeiffer CM, Caudill SP, Gunter EW, Osterloh J, Sampson EJ. Biochemical indicators of B vitamin status in the US population after folic acid fortification: results from the National Health and Nutrition Examination Survey 1999–2000. Am J Clin Nutr [Internet]. 2005 Aug 1;82(2):442–50.
6. Allen LH. How common is vitamin B-12 deficiency? Am J Clin Nutr [Internet]. 2009 Feb 1;89(2):693S-696S.
7. Russell RM, Suter PM. Vitamin requirements of elderly people: an update. Am J Clin Nutr [Internet]. 1993 Jul 1;58(1):4–14.
8. Andrès E, Loukili NH, Noel E, Kaltenbach G, Abdelgheni M Ben, Perrin AE, et al. Vitamin B12 (cobalamin) deficiency in elderly patients. CMAJ [Internet]. 2004 Aug 3;171(3):251–9.
9. Cheema A, Bramson J, Bajwa R, Hossain MA, Asif A. Hemolytic Anemia an Unusual Presentation of Vitamin B12 Deficiency. J Hematol Thromboembolic Dis [Internet]. 2018;06(01).
10. Wolffenbuttel BHR, Wouters HJCM, Heiner-Fokkema MR, van der Klauw MM. The Many Faces of Cobalamin (Vitamin B12) Deficiency. Mayo Clin Proc Innov Qual Outcomes [Internet]. 2019 Jun;3(2):200–14.
11. Stabler SP, Allen RH, Savage DG, Lindenbaum J. Clinical spectrum and diagnosis of cobalamin deficiency. Blood [Internet]. 1990 Sep 1;76(5):871–81.
12. Carmel R. Current Concepts in Cobalamin Deficiency. Annu Rev Med [Internet]. 2000 Feb;51(1):357–75.
13. Swain R. An update of vitamin B12 metabolism and deficiency states. J Fam Pract [Internet]. 1995 Dec;41(6):595–600.
14. Dharmarajan TS, Adiga GU, Norkus EP. Vitamin B12 deficiency. Recognizing subtle symptoms in older adults. Geriatrics [Internet]. 2003 Mar;58(3):30–4, 37–8.



