DESCRIÇÃO DO CASO
Mulher de 24 anos, previamente saudável, recorreu ao Serviço de Urgência por quadro com 1 mês de evolução de tosse produtiva com expetoração mucopurulenta e cansaço fácil. Referia ligeira disfagia para sólidos e negava sintomas constitucionais ou outra sintomatologia de órgão.
Na avaliação inicial apresentava bom estado geral, estava hemodinamicamente estável, apirética e eupneica. Na auscultação pulmonar detetava-se diminuição do murmúrio vesicular no terço inferior do hemitórax direito e a auscultação cardíaca era normal. Não apresentava adenopatias periféricas nem alterações da orofaringe. A avaliação analítica revelou proteína C reativa (PCR) e lactato desidrogenase (LDH) elevadas (6,72mg/dL e 1285UI/L respetivamente). O hemograma, coagulação, função renal, ionograma, parâmetros de cito-colestase, função tiroideia e gasimetria arterial eram normais. A telerradiografia de tórax póstero-anterior realizada à admissão objetivou hipotransparência dos dois terços inferiores do hemitórax direito com linha de Damoiseau, sugestiva de derrame pleural (Fig. 1).
Realizou tomografia axial computorizada (TC) do tórax que demonstrou uma volumosa lesão neoformativa, predominantemente sólida mas com áreas de necrose, centrada no mediastino anterior de aproximadamente 17,5x11,5cm, envolvendo estruturas vasculares e determinando estenose crítica do tronco venoso braquiocefálico esquerdo e da veia cava superior. Associava-se derrame pleural loculado de moderado volume condicionando atelectasia do pulmão direito e espessamento pleural, com áreas nodulares suspeitas de implantes pleurais. Eram descritas múltiplas adenomegalias mediastínicas (Fig. 2).
Realizada toracocentese diagnóstica que mostrou líquido pleural turvo e hemático cujas características citoquímicas eram compatíveis com empiema (pH 7.33, 4512/uL células, 93,6% linfócitos, glicose 41mg/dL, adenosinadeaminase 150U/L, relação LDH líquido pleural e sérico de 2,4, relação de proteínas totais líquido pleural e sérico de 0,6 e exames microbiológicos nomeadamente paraMycobacterium tuberculosisnegativos). A pesquisa de células neoplásicas foi negativa.
Assumiu-se neoplasia do mediastino anterior e a doente foi transferida para investigação complementar. Realizou ecografia torácica que confirmou líquido pleural exuberante, não septado e de aspeto não puro, a condicionar atelectasia passiva do parênquima pulmonar. Foi colocada drenagem torácica e realizada biópsia pleural. Perante o quadro clínico colocaram-se as hipóteses diagnósticas de tumor germinativo, timoma ou linfoma. Para exclusão de tumor de células germinativas foram doseadas: gonadotrofina coriónica sérica (ß-hCG) e alfa-fetoproteína, ambas negativas (<0,2mUl/mL e 1,03ng/mL respetivamente). Do restante estudo analítico solicitado destaca-se: ß-2 microglobulina 2,97 mg/L [0,8-2,4] e LDH aumentada, já mencionada, ambas a favorecer a hipótese diagnóstica de linfoma. As serologias para o vírus da imunodeficiência humana (VIH), da hepatite C (VHC) e B (VHB) foram negativas. Para caracterização histológica realizou ecoendoscopia endobrônquica (EBUS), que objetivou abaulamento da traqueia por compressão extrínseca desde o terço proximal até à carina, não permitindo a progressão do ecoendoscópio (Fig. 3). Foram realizadas biópsias. O resultado anatomopatológico da biópsia pleural e da massa mediastínica foi compatível com Linfoma não-Hodgkin Primário do Mediastino de Grandes Células B (LPMGC) (Fig. 4).
Foi complementado o estadiamento com TC abdomino-pélvica, sem alterações relevantes, e mielograma e biópsia óssea, que excluíram infiltração medular, definindo assim estadio IA (de acordo com o sistema de classificação deAnn Arbor), IPI 1 (de acordo com o índice de prognóstico internacional). Pela gravidade imagiológica de compressão vascular crítica do tronco braquiocefálico e veia cava superior iniciou corticoterapia e foi avaliada em consulta de Hematologia, sendo proposta para 6 ciclos de quimioterapia com R-CHOP-14 (rituximab, ciclofosfamida, doxorrubicina, vincristina e prednisolona) e radioterapia de consolidação sobre o mediastino. A doente acabou por não responder (assumida falência terapêutica ao 5º ciclo), estandoatualmente em segunda linha de tratamento e a aguardar transplante autólogo de medula óssea (TAMO).
DISCUSSÃO
Os tumores do mediastino anterior representam metade das massas mediastínicas1e, apesar de cerca de dois terços destas serem benignas, 60% das localizadas no mediastino anterior são malignas.2As causas mais comuns de massas mediastínicas anteriores malignas são os timomas, tumores de células germinativas, tumores da glândula tiroideia e linfomas, estes últimos responsáveis por 25% dos casos.2É frequente o mediastino ser comprometido em linfomas sistémicos no entanto a doença isolada do mediastino é incomum. Os linfomas primários do mediastino correspondem a apenas 10% dos linfomas mediastínicos, são na maioria LH, sendo os LNH ainda menos comuns.2O LPMGC é uma variante do Linfoma Difuso de Grandes Células B (LDGCB) e distingue-se deste por caraterísticas epidemiológicas, clínicas e imunohistoquímicas únicas,compartilhando algumas semelhanças com o LH clássico tipo esclerose nodular. Estas características ímpares tornam este tumor muito raro, cerca de 3% dos LNH3e a 6-10% dos LDGCB.4
Do ponto de vista epidemiológico, idade e género são fatores preponderantes na avaliação inicial do doente, uma vez que atinge sobretudo mulheres adultas jovens com idade média entre os 30 e os 40 anos.3
Clinicamente, os doentes apresentam-se assintomáticos ou com sintomas inespecíficos, relacionados com a compressão ou invasão de estruturas anatómicas adjacentes. O sintoma local mais frequente é a tosse, e outros sintomas comuns são a precordialgia, dispneia, disfonia, hemoptises e disfagia. Os doentes podem apresentar manifestações sistémicas (como sintomas B) ou, tumores com mais de 10cm,3síndrome da veia cava superior. É comum os LPMGC apresentarem-se como uma massa grande no mediastino, sendo a extensão intratorácica com invasão do pulmão, pleura, pericárdico e parede torácica frequente. Em casos avançados pode existir disseminação à distância, mas o envolvimento medular é raro. Analiticamente, 80% dos casos apresentam aumento da LDH e ß-2 microglobulina normal.3A presença de células malignas no líquido pleural traduz disseminação, no entanto orendimento diagnóstico do exame citológico é bastante variável (62% a 90%).5Perante forte suspeita de malignidade deve ser colhida uma segunda amostra e, se suspeita de linfoma, estudo complementar com citometria de fluxo.
Uma massa mediastínica anterior é o achado predominante na avaliação inicial por telerradiografia ou TC torácica. A TC ou ressonância magnética de corpo são modalidades de primeira linha para avaliar os componentes teciduais da massa, grau de vascularização, relação com estruturas adjacentes e extensão do tumor. Contudo, embora sejam valiosas no estadiamento e posterior avaliação após terapêutica, têm baixa sensibilidade prognóstica. Atomografia por emissão de positrões (PET) com fluorodesoxiglicose(FDG) é cada vez mais usada como procedimento padrão: identifica numa fase inicial disseminação à distância, é útil para monitorizar resposta ao tratamento e deteta doença recidivante, uma vez que distingue tumor viável de massa residual. Em linfomas ávidos por FDG como o LPMGC a FDG-PET/ TC é recomendada no pré-tratamento e na avaliação da resposta,6embora apresente uma elevada taxa de falsos positivos após tratamento, principalmente em doentes jovens.Embora seja rara a disseminação deve ser descartado envolvimento medular e do sistema nervoso central.
A caracterização histológica é essencial para classificar o tumor e decidir o plano terapêutico, podendo ser um desafio. As biópsias transtorácica, transbrônquica ou por mediastinoscopia são úteis para obtenção de material tumoral para diagnóstico histológico definitivo embora não seja raro a presença de extensa fibrose e necrose, o que diminui a rentabilidade destas técnicas, e impõe a realização de técnicas cirúrgicas invasivas. A EBUS com punção aspirativa por agulha fina, técnica minimamente invasiva e eficaz, está bem estabelecida, permitindo o diagnóstico e por vezes o estadiamento.7Do ponto de vista imuno-histoquímico, os rearranjos de C-MYC, BCL2 e/ou BCL6 são comuns no LDGCB e estão normalmente ausentes noLPMGCo que ajuda a diferenciar este tipo de tumor. No entanto, estudos demonstraram que quando presentes podem estar associados a um prognóstico mais desfavorável, devendo ser excluídos.8
Os linfomas do mediastino são agressivos, e o LPMGC não é exceção. Embora o IPI possa ser útil, não é muito discriminatório e muitas vezes é baixo apesar da gravidade da doença.3,4A doente descrita tinha IPI de 1, considerada de baixo risco, ainda que o tumor não tenha respondido à terapêutica de primeira linha.
Os LPMGC são tumores raros e a escassez de dados prospetivos e estudos randomizados relativamente à abordagem terapêutica ideal torna-a muito controversa. Modalidades combinadas de quimioterapia intensiva (CHOP) com rituximab seguidas de radioterapia de consolidação têm demonstrado ser eficazes em doentes de baixo risco, mas parecem insuficientes em doentes de alto risco, associando-se a alta taxa de doença refratária.6,9Estudos sugerem eficácia promissora de protocolos com DA-EPOCH-R (dose ajustada de etoposido, prednisona, vincristina, ciclofosfamida e doxorubicina com rituximab) sem radiação, que para além dos resultados (taxas de resposta completa e sobrevida sem eventos aos três anos superiores a 90%) evitam possíveis complicações a longo prazo da radiação sobre o mediastino.9Perante recidivas ou doença refratária pode ser usada quimioterapia de altas doses seguida do TAMO.
Em termos prognósticos a sobrevida estimada aos cinco anos é de 64%, com curso clínico após terapêutica mais favorável no LPMGC do que no LDGCB.4Cerca de 10 a 30% dos doentes têm doença refratária ou recidivam após terapêutica de primeira linha10e as recidivas são precoces, habitualmente nos 18 meses após terminar o tratamento,9sendo raras após dois anos.4Não obstante, a taxa de cura para doença progressiva ou recorrente após terapêutica de primeira linha é baixa, pelo que é fundamental otimizar a terapêutica inicial. A melhoria na sobrevida deve-se ao diagnóstico e início terapêutico mais precoces, ainda que a agressividade e rápida evolução destes tumores aliados à indefinição do tratamento ideal imponha muitos desafios na gestão destes doentes.
Figura I
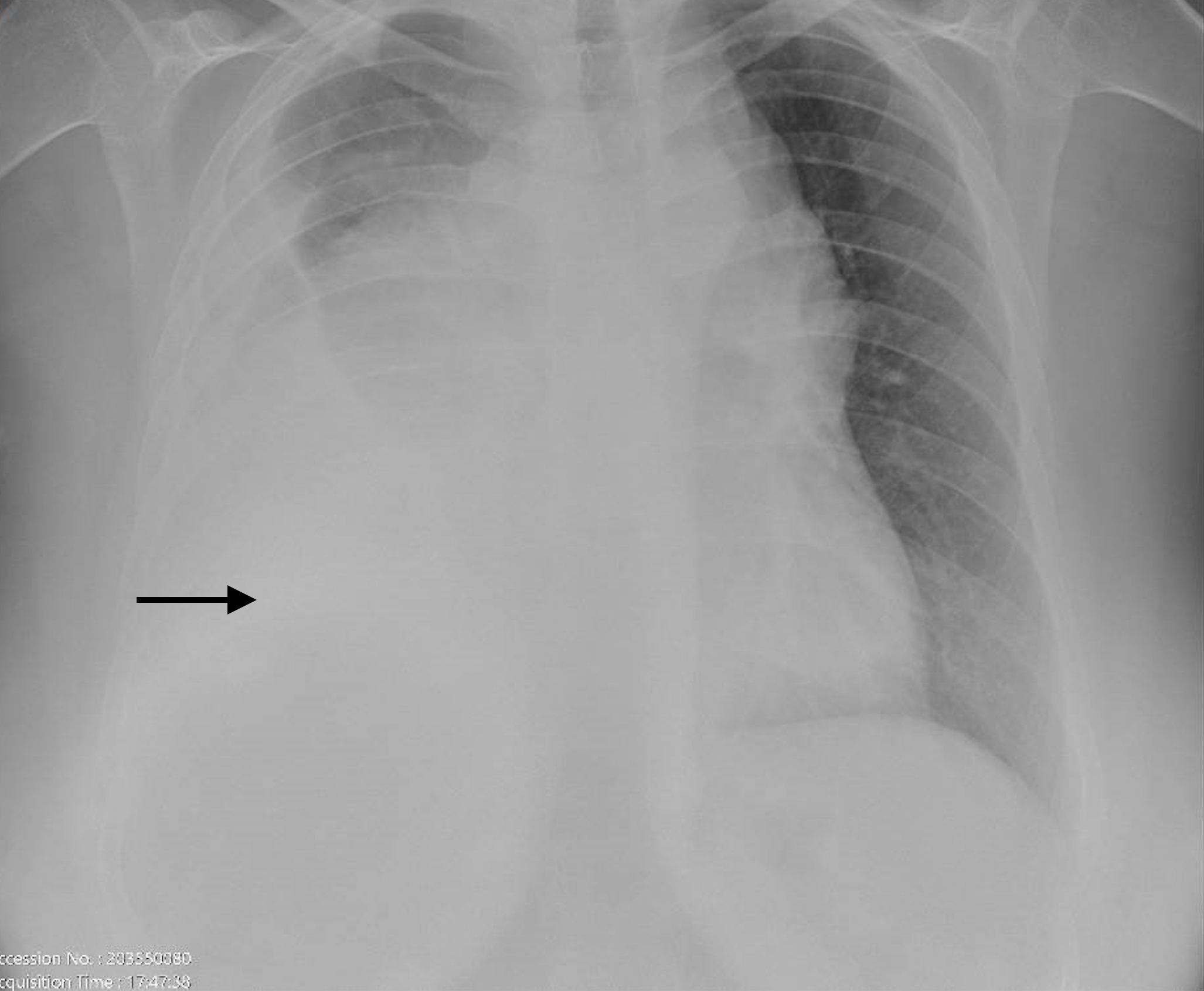
Telerradiografia do tórax postero-anterior à admissão mostrando volumoso derrame pleural direito (seta).
Figura II
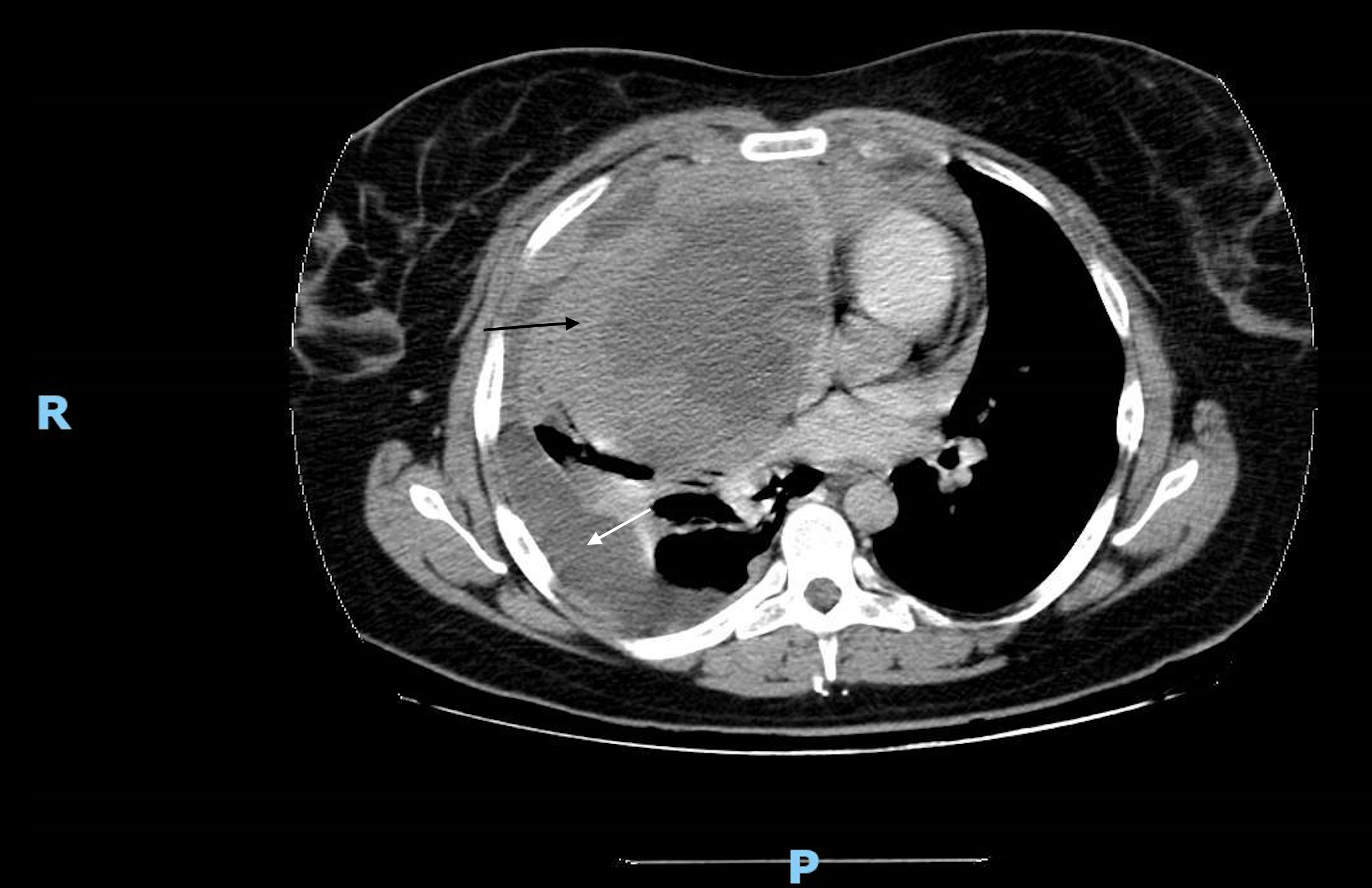
Tomografia axial computorizada torácica mostrando massa no mediastino anterior (seta preta) e derrame pleural volumoso (seta branca) a condicionar colapso pulmonar direito.
Figura III
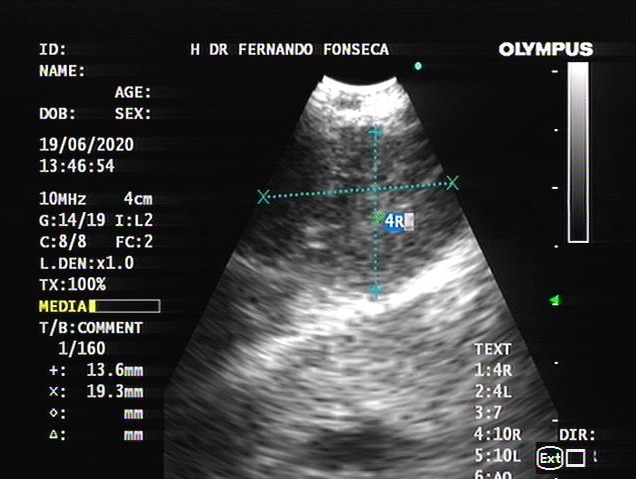
Ecoendoscopia endobrônquica mostrando massa de cerca de 13.6x19.3mm na parede anterior da traqueia.
Figura IV

Histopatologia do tecido (microscopia óptica): células grandes, com citoplasma claro e abundante e com padrão de crescimento difuso, com núcleos polimórficos (seta).
BIBLIOGRAFIA
1. Juanpere S, Cañete N, Ortuño P, Martínez S, Sanchez G, Bernado L. A diagnostic approach to the mediastinal masses. Vol. 4, Insights into Imaging. Springer; 2013. p. 29–52.
2. Anterior Mediastinal Mass - PubMed [Internet]. [cited 2021 Feb 7]. Available from: https://pubmed.ncbi.nlm.nih.gov/31536215/
3. Ouassou S, Herrak L, Achachi L, Nachite F, Znati K, El Ftouh M. Lymphome B à grandes cellules primitif du médiastin chez la femme: À propos de cinq cas. Pan Afr Med J. 2016 Jun 30;24:1937–8688.
4. De J, Lino A, Bahia S(. Linfomas Primários de Mediastino: Uma Revisão de Literatura 2013 UNIVERSIDADE FEDERAL DA BAHIA Faculdade de Medicina da Bahia.
5. Teixeira LR, Pinto JADF, Marchi E. Malignant pleural effusion. Vol. 32, Jornal Brasileiro de Pneumologia. Sociedade Brasileira de Pneumologia e Tisiologia; 2006. p. S182–9.
6. Pfau D, Smith DA, Beck R, Gilani KA, Gupta A, Caimi P, et al. Primary Mediastinal Large B-Cell Lymphoma: A Review for Radiologists. Am J Roentgenol. 2019 Nov 15;213(5):W194–210.
7. Thiryayi SA, Rana DN, Narine N, Najib M, Bailey S. Establishment of an endobronchial ultrasound-guided transbronchial fine needle aspiration service with rapid on-site evaluation: 2 years experience of a single UK centre. Cytopathology. 2016 Oct 1;27(5):335–43.
8. Jiang Y, Mo W, Miao Y, Liang Y, Li Y, Zhang R. Primary mediastinal large B cell lymphoma with coexisting aberrations of C-MYC and BCL-2: a case report and literature review. Med Mol Morphol. 2020 Jun 1;53(2):124–9.
9. Dunleavy K, Wilson WH. Primary mediastinal B-cell lymphoma and mediastinal gray zone lymphoma: Do they require a unique therapeutic approach? Vol. 125, Blood. American Society of Hematology; 2015. p. 33–9.
10. Takyar J, Raut M, Borse R, Balakumaran A, Sehgal M. Relapsed/refractory primary mediastinal large B-cell lymphoma: a structured review of epidemiology, treatment guidelines and real-world treatment practices. Expert Rev Hematol. 2020 Mar 3;13(3):275–87.





