Introdução
As manifestações da miocardite variam desde alterações eletrocardiográficas assintomáticas, sintomas inespecíficos (como febre ou mialgias), sintomas cardiovasculares (palpitações, cansaço, dispneia de esforço, ortopneia), até ao espetro do choque cardiogénico e morte.1 A diversidade de apresentações clínicas, aliada à elevada morbimortalidade, implica que seja necessário um alto nível de suspeição para que o tratamento seja precoce e adequado.
A etiologia vírica é a mais frequente. Desde o desenvolvimento das técnicas moleculares, principalmente apolymerase chain reaction (PCR), sabemos que os vírus mais frequentemente causadores de miocardite nos países desenvolvidos são o enterovírus, adenovírus, influenza, vírus herpes humano-6, vírus Epstein-Barr, citomegalovírus, hepatite C e parvovírus B19 .2,3
Menos frequentemente, a miocardite é secundária a uma causa infeciosa não vírica (bactérias, parasitas, micobactérias…), reações de hipersensibilidade a fármacos/tóxicos, autoimune, entre outras (Tabela 1).
A biópsia endomiocárdica é ogold-standardpara o diagnóstico definitivo; permite identificar o subtipo de inflamação; bem como orientar o diagnostico etiológico (por histologia, imunohistoquímica, culturas ou técnicas moleculares). Quando realizada por equipas treinadas, o risco associado ao procedimento é muito baixo (0,3-5,5%)(4), mas é um método restrito a centros com experiência; e por isso, recomendada apenas nas apresentações clínicas graves.4
A ressonância magnética cardíaca tem cada vez mais relevância diagnóstica. É razoável como abordagem prévia à biópsia em doentes estáveis, mas também não está disponível em todos os centros.
Desta forma, muitas vezes recorremos ao estudo serológico para identificar um agente causador, porém, é importante sublinhar que uma serologia positiva demonstra interação entre o sistema imunitário e o agente microbiano, mas não implica uma infeção ativa do miocárdio. Na população em geral, a seroprevalência de IgG contra vários vírus cardiotrópicos é elevada mesmo na ausência de infeção. Em diversos estudos, as serologias não se mostraram concordantes com o genoma viral detetado por técnicas moleculares na biópsia endomiocárdica.5 Desta forma, a pesquisa por rotina de serologias não está recomendada. A exceção, está, segundo aTask Force da European Cardiology Society, para os poucos agentes em que as serologias se correlacionaram com os achados na biopsia endomiocárdica: vírus da imunodeficiência humana; hepatite C; infeção porRicketsiaeBorrelia burgdoferi.3
Caso Clínico
Apresentamos o caso de uma mulher de 72 anos, reformada de cabeleireira, autónoma e residente em área urbana; sem outro contexto epidemiológico de relevo; e com história pessoal de hipertensão arterial e dislipidémia, medicadas.
Recorre ao serviço de urgência, previamente à pandemia por SARS-COV2, com uma semana de evolução de coriza, tosse irritativa, mialgias, cansaço, tonturas e mal-estar generalizado. Na primeira observação clínica, não se constatam alterações semiológicas de destaque, à exceção de discretos fervores sub-crepitantes bi-basais na auscultação pulmonar.
Da avaliação analítica, a sublinhar ausência de anemia (hemoglobina 14 g/dl, hematócrito 42%); leucograma normal (leucócitos 5400 x103ul; 4110 neutrófilos; 1100 linfócitos; 0,1% eosinófilos); sem alterações plaquetárias ou da coagulação; lesão renal aguda AKIN 1 (creatinina 1,49 mg/dl; ureia 80 mg/dl; sem distúrbios iónicos ou do equilíbrio ácido-base); ligeira citólise hepática (AST 48 UI/L; ALT 56 UI/L; LDH 323 UI/L); elevação dos marcadores de lesão miocárdica (troponina I 10,5 ug/L – valor de referência < 0,16 ug/L - com evolução crescente nas 72h posteriores até 40 ug/L) e discreta elevação de marcadores inflamatórios (PCR 5 mg/dl – valor de referência < 0,5 mg/dl).
O eletrocardiograma revelou supra-desnivelamento côncavo e difuso do segmento ST (Fig. 1); e o ecocardiograma transtorácico demonstrou ventrículo esquerdo não dilatado com paredes ligeiramente espessadas; sem alterações da cinética segmentar; fração de ejeção moderadamente comprometida (por método “eyeball”); sem doença valvular relevante; e derrame pericárdico ligeiro.
Foi submetida a cateterismo de urgência noutra unidade hospitalar com Cardiologia de Intervenção, sem intercorrências e que demonstrou coronárias angiograficamente normais.
Porém, constatou-se rápida evolução para choque cardiogénico, com necessidade de ventilação mecânica invasiva, suporte vasopressor e inotrópico. Iniciou empiricamente, amoxicilina-clavulanato, azitromicina e oseltamivir (que cumpriu por 7 dias), pela presunção de etiologia infeciosa, embora sem agente etiológico identificado até então.
Apesar das medidas instituídas, ao 3º dia de evolução, verifica-se agravamento do choque cardiogénico e sinais de tamponamento cardíaco, tendo sido realizada pericardiocentese emergente e drenados ~25 ml de líquido amarelo citrino. Foi posteriormente transferida para centro de referência comECMO, onde permaneceu canulada durante 12 dias.
Após estabilidade clínica, e já sem necessidade de terapêutica de suporte de órgão, foi re-transferida, embora mantendo clínica de insuficiência cardíaca com sintomas congestivos; temperatura timpânica oscilando entre 37,5 – 37,9 º C; tosse irritativa e padrão radiológico com infiltrado intersticial e bilateral, periférico; e de novo, tetraparésia flácida com força muscular grau 2 em todos os membros, sem elevação de CK ou aldolase; e com eletromiograma compatível com miopatia de predomínio proximal, assumida em contexto de imobilidade (miopatia dos cuidados intensivos).
Dos restantes exames complementares realizados, existe a destacar:
- Tomografia de tórax (Fig. 2) a demonstrar focos de densidade em “vidro despolido”, de predomínio periférico, formando consolidações focais nas bases pulmonares; espessamento parietal brônquico difuso bilateral; e adenomegalias mediastínicas inespecíficas. Sem evidência de tromboembolismo pulmonar.
- Análise do líquido pericáridico a revelar um exsudado6; amarelo turvo; com densidade elevada (1,025); pH 7.0; proteínas elevadas (3,9 g/dl); razão entre proteínas no fluído/ proteínas no soro > 0,5; LDH elevada (1376 UI/L); leucócitos 180 leuc/uL com predomínio de polimorfonucleares (56%). Exames culturais bacteriológicos e micobacteriológicos (por PCR e cultural, após 42 dias de incubação) sem isolamento de agente.
- Biópsia endomiocardica: insuficiente para diagnóstico (2 fragmentos correspondem a gordura; e 2 fragmentos do endomiocárdio sem infiltrado inflamatório; sem critérios de miocardite).
- Hemoculturas seriadas negativas.
- Antigenúrias paraStreptococcus pneumoniaeeLegionella pneumophilanegativas. Zaragatoa para vírus Influenza negativas. Imunoserologia para VIH, hepatite B e hepatite C negativa. IgG positivo para vários vírus cardiotrópicos, no entanto com IgM negativo. Destaque para IgM positivo (em dois doseamentos pelo métodoELISA - Enzime Linked Immunosorbent Assay) paraBorrelia burgdorferi, com IgG negativo.
- Do estudo imunológico, ANA positivo (padrão fino granular, título 1/640) com toda a restante imunologia negativa (anti-nucleossoma, anti-histonas, anti-SSA, anti-SSB, anti-Sm, anti-RNP, anti-Jo, anti-SLA/LP, ANCA-MPO, ANCA-PR3 e anticorpos antifosfolípidos). Sem consumo de complemento.
Atentando à serologia IgM paraBorrelia Burgdoferie à possibilidade de estarmos perante uma Borreliose de Lyme, iniciou antibioterapia com ceftriaxone endovenoso 2g/dia, que cumpriu por 21 dias. Uma semana após o início da antibioterapia, apresentava-se em classe funcional NYHA I com NTpro-BNP em curva descendente e ecocardiograma de controlo a revelar recuperação da função ventricular. Apresentava-se ainda apirética; sem clínica respiratória; e com franca recuperação motora e funcional (Fig. 3).
Discussão:
Borreliose de Lyme
A doença de Lyme é causada pela bactériaBorrelia burgdorferi, transmitida pela picada de carraça, sobretudo durante os meses mais quentes. A borreliose de Lyme geralmente progride em três fases:
- O primeiro sintoma (~ 70-80% dos casos) é a erupção cutânea no local da inoculação e que após 3-30 dias, dá origem aoeritema migrans. Este é inicialmente localizado mas pode alastrar, acompanhado a disseminação hematogénica. Outros sintomas incluem febre, cefaleia, mialgias, artralgias e fadiga. Sintomas respiratórios e gastrointestinais são menos comuns. Embora a mialgia esteja frequentemente presente, a miosite é uma manifestação rara com apenas 28 casos relatados (confirmados por serologia, ressonância magnética e biópsia muscular)7; e a miopatia também está descrita, podendo apresentar-se sob a forma de dermatomiosite-like.8
- Se não for tratada, a doença progride em semanas-meses, para a segunda fase que atinge sobretudo o sistema nervoso (parésia facial, meningite linfocítica, encefalite, mielite, radiculopatias ou neuropatia periférica) e cardiovascular. As manifestações cardíacas da doença de Lyme ocorrem em 4% a 10% dos casos e incluem bloqueio auriculoventricular; arritmias supraventriculares e ventriculares; ou mais raramente, a miocardite (0,5% das infeções).9 O prognóstico depende da terapêutica de suporte e antibioterapia precoce. Mesmo que exista melhoria clínica associada à terapêutica de suporte, a antibioterapia deve ser aplicada para prevenir uma cardiomiopatia crónica e outras manifestações da borreliose tardia.10,11
- Na sua fase tardia e crónica, predomina o envolvimento articular marcado por dor. A artrite de Lyme afeta sobretudo grandes articulações, especialmente o joelho, evoluindo para importante degeneração articular.
O diagnóstico é feito pela identificação do agente bacteriano, no entanto, as hemoculturas paraBorrelia burgdorferinão estão disponíveis comercialmente; e a sua deteção por método PCR, ainda que diagnóstica, não está acessível a todos os centros laboratoriais. O teste sorológico é o principal meio de diagnóstico na doença de Lyme. O CDC (Centers for Disease Control and Prevention) recomenda um processo de teste serológico em duas etapas: o uso de um ensaio imunoenzimático (ELISA) ou ensaio por imunofluorescência indireta, que são métodos sensíveis; seguido de confirmação por método de imunotransferência (Western-blot), muito sensível e específico, mas de custo elevado, pelo que não é realizado em primeira linha. Mais recentemente, segundo a FDA (Food and Drug Administration), o diagnóstico pode ser considerado provável perante dois ensaios por ELISA positivos.12,13
A terapêutica com doxiciclina oral, amoxicilina ou cefuroxima tem eficácia equivalente no tratamento da doença de Lyme inicial. Formas graves de doença neurológica ou cardíaca devem ser tratadas com antibioterapia endovenosa, como ceftriaxona ou penicilina por 14-21 dias.14
Conclusão e limitações:
Os autores apresentam o presente caso pela gravidade da sua apresentaçãoab initio; e pela raridade do envolvimento miopericárdico e muscular na doença de Lyme.
Como principal limitação, destacamos a ausência de outro método confirmatório de diagnóstico, além do estudo serológico. Tanto no líquido pericárdico como na biópsia endomiocárdica não foi realizada a pesquisa por método PCR paraBorrelia burgdoferi, uma vez que a suspeita clínica só surgiu posteriormente com o resultado da serologia.
Figura I
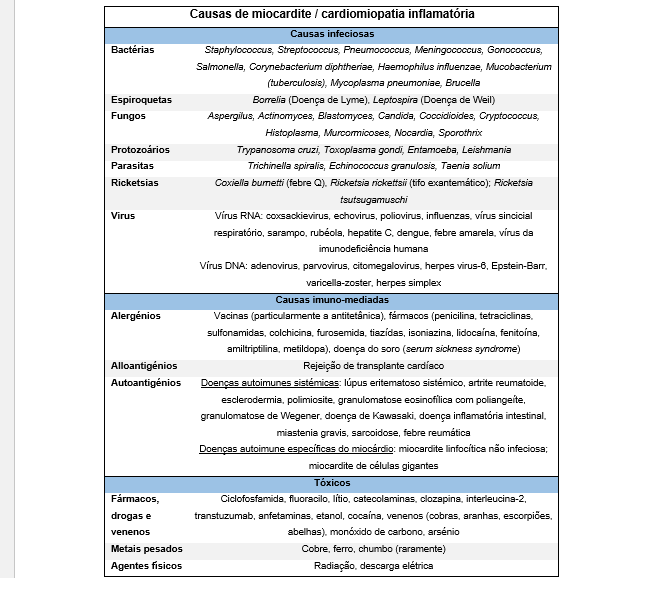
Tabela 1: Causas de miocardite / miocardiopatia inflamatória. Tabela adaptada do documento publicado em 2013 pelo Grupo de Trabalho da Sociedade Europeia de Cardiologia sobre Doenças do Miocárdio e Pericárdio (3).
Figura II
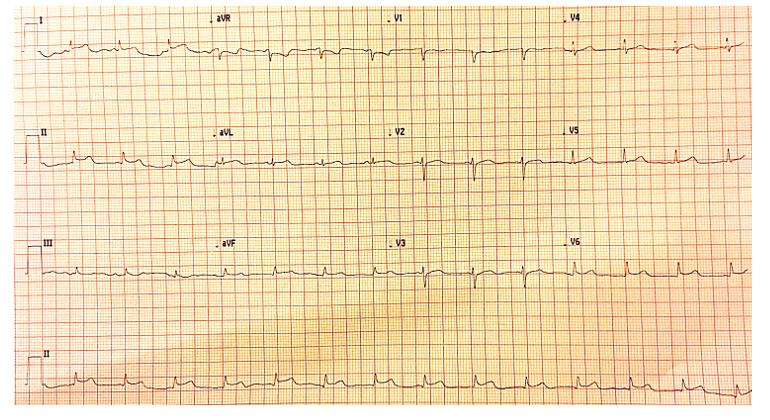
Figura 1: Eletrocardiograma de 12 derivações realizado à admissão no serviço de urgência.
Figura III
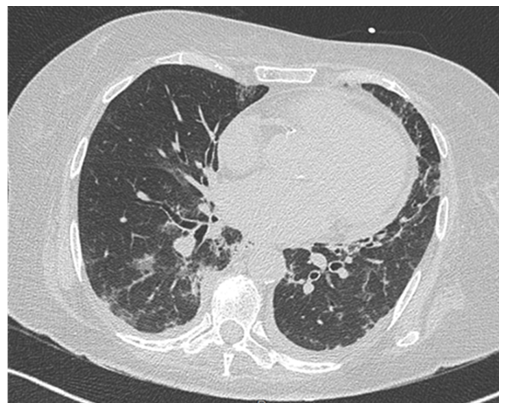
Figura 2: Tomografia computorizada a demonstrar infiltrados pulmonares de predomínio periférico e adenopatias mediastínicas.
Figura IV
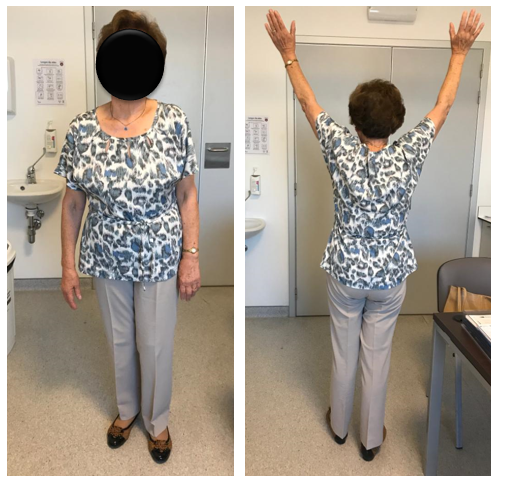
Figura 3: Na segunda semana de antibioterapia com ceftriaxone, a doente recuperou o status funcional prévio ao internamento.
BIBLIOGRAFIA
1. Faria R, Pereira S, Santos W, Marques N, Franco F, Sousa P, et al. Miocardite fulminante – a propósito de um caso clínico. Revista Portuguesa de Cardiologia. 2012: Volume 31, 503-7.
2. Ammirati E, Frigerio M, Adler E, Basso C, Birnie DH, Brambatti M, et al. Management of Acute Myocarditis and Chronic Inflammatory Cardiomyopathy. Review Article. Circulation: Heart Failure. 2020: Volume 13, Issue 11:e007405.
3. Caforio A, Pankuweit S, Arbustini E, Basso C, Gimeno-Blanes J, Felix SB, et al. Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. European Heart Journal. 2013: Volume 34, Issue 33, Pages 2636–48.
4. Dickstein K, Cohen-Solal A, Filippatos G, et al. ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2008: the task force for the diagnosis and treatment of acute and chronic heart failure 2008 of the European society of Cardiology. Eur J Heart Failure. 2009: Volume 10, 933-89
5. Mahfoud F, Gärtner B, Kindermann M, Ukena C, Gadomski K, Klingel K, et al. Virus serology in patients with suspected myocarditis: utility or futility. European Heart Journal. 2011: Volume 32, Issue 7, Pages 897–903.
6. Buoro S, Tombetti E, Ceriotti F, Simon C, Cugola D, Seghezzi M, et al. What is the normal composition of pericardial fluid? Heart Published Online. 2020. doi: 10.1136/heartjnl-2020-317966.
7. Holmgren AR, Matteson EL. Lyme myositis. Arthritis Rheum. 2006. Volume 54(8), 2697-2700.
8. Scarti L, Baldoni D, Morelli C, Francini V, Bisogni B, Cecchi L. Acute reversible degenerative myopathy complicating Lyme disease: description of a case. InfezMed. 1998;6(2): 96-8.
9. Lelovas P, Dontas I, Bassiakou I, Xanthos T. Cardiac implications of Lyme disease, diagnosis and therapeutic approach. Int J Cardiology. 2008. Volume 129, pages 15-21.
10. Željko Župan et al. Successful treatment of fulminant Lyme myocarditis with mechanical circulatory support in a young male adult: a case report. Croat Med J. 2017. 58:185-93.
11. Yoon EC, Vail E, Kleinman G, Lento PA , Li S, Wang G, et al. Lyme disease: a case report of a 17-year-old male with fatal Lyme carditis. Cardiovasc Pathology. 2015. 24:317-21.
12. Mead P; Petersen J; Hinckley A. Updated CDC Recommendation for Serologic Diagnosis of Lyme Disease. Weekly. 2019. Volume 68(32), page 703.
13. Aberer E; Schwantzer G. Course of antibody response in Lyme Borreliosis patients before and after therapy. International Scholarly Research Network. Volume 2012, Article ID 719821.
14. CDC – National Center for Health Statistics – Homepage: Lyme disease. https://www.cdc.gov/lyme/index.html. March 21, 2021.





