A endocardite trombótica não bacteriana (ETNB) é uma forma de endocardite não infeciosa cuja fisiopatologia não é totalmente conhecida, acreditando-se que um estado de hipercoagulabilidade e lesão endotelial sejam fundamentais para o seu desenvolvimento. Assim, a ETNB está classicamente associada a doenças neoplásicas, autoimunes, mais frequentemente ao lúpus eritematoso sistémico, ou a outros estados pró-inflamatórios como sépsis e queimaduras extensas.¹ Pela fragilidade dos pontos de contacto entre as vegetações (constituídas por trombos plaquetários) e o endocárdio, a embolização das vegetações é frequente e os eventos tromboembólicos são manifestações clínicas comuns.² Assim, o tratamento da ETNB inclui hipocoagulação.³ A sua associação com arterite de células gigantes (ACG) é muito rara estando descritos apenas três casos na literatura.4-6 A ACG envolve artérias de grande e médio calibre, podendo conduzir a ectasia, oclusão ou estenose destes vasos e, consequentemente, a eventos isquémicos, aneurismas, disseções e ruturas arteriais.⁷ Um estudo retrospetivo mostrou que doentes com este tipo de arterite apresentavam maior probabilidade de ter anomalias cardíacas no ecocardiograma, nomeadamente regurgitação da válvula mitral, espessamento, estenose ou insuficiência da válvula aórtica, regurgitação da válvula tricúspide, derrame pericárdico e ETNB comparativamente ao grupo de controlo.⁵ No entanto, a relação de ACG com anomalias ecocardiográficas, nomeadamente ETNB e os mecanismos fisiopatológicos subjacentes não são ainda compreendidos.
Os autores descrevem o caso de uma mulher de 78 anos com história de esclerose ligeira da válvula aórtica sem alterações funcionais em ecocardiograma transtorácico (ETT) feito 2 anos antes, sem outros antecedentes ou contexto epidemiológico de relevo e sem medicação crónica, que recorreu ao Serviço de Urgência por clínica com 2 meses de evolução de cefaleia occipito-temporal, claudicação da mandíbula de agravamento progressivo e febre recorrente com temperatura axilar máxima de 39,5ºC sem predomínio circadiano e sem outra sintomatologia associada. Em ambulatório, cumpriu 8 dias de amoxicilina e ácido clavulânico, 8 dias de doxiciclina e 3 dias de azitromicina sem melhoria clínica.Na admissão hospitalar, ao exame objetivo, apresentava bom estado geral, com tensão arterial de 160/64 mmHg, pulso amplo e arrítmico com frequência de 145 batimentos por minuto, temperatura subfebril (temperatura axilar de 37,6ºC), dor com palpação de ambas as artérias temporais, limitação da mobilidade ativa das articulações temporomandibular e sopro sistólico grau III/VI audível no foco aórtico sem irradiação. O estudo analítico revelou proteína C reativa (PCR) de 101,5 mg/L (n <5 mg/L), velocidade de sedimentação (VS) de 110 mm/1ªh (n <30 mm/1ªh) e hemoglobina de 11,3 g/dL (n 12-16 g/dL); restante hemograma, ionograma, função renal, perfil hepático e estudo de coagulação sem alterações. O eletrocardiograma evidenciou fibrilhação auricular (FA) com resposta ventricular rápida (frequência cardíaca de 132 bpm) cuja frequência normalizou após normalização da temperatura corporal com paracetamol. Durante o internamento no Serviço de Medicina Interna, a investigação da síndrome inflamatória, que incluiu tomografia computorizada (TC) cerebral e cervico-toraco-abdominopélvica, não permitiu identificar abcessos cerebrais e focos infeciosos urinários, respiratórios ou orofaríngeos. Pela clínica sugestiva de ACG, realizouecodopplerdas artérias temporais que revelou um halo hipoecogénico bilateral, sinal de elevada especificidade para arterite temporal⁸ (Fig.s 1 e 2). No segundo dia de internamento, por clínica de amaurose fugaz e suspeita de envolvimento das artérias retinianas pela arterite, iniciou pulsos de corticóide (1 g/dia de metilprednisolona) durante 3 dias. A doente foi observada por Oftalmologia que excluiu fenómenos vasculíticos. Foram também excluídas complicações da ACG em grandes vasos torácicos e abdominais com angioTC toracoabdominal. Manteve tratamento com 1mg/kg/dia de prednisolona e 4 dias após o seu início, realizou biópsia de artéria temporal que não mostrou achados sugestivos de vasculite.Pelo sopro sistólico, realizou ETT que identificou uma imagem nodular na cúspide coronária esquerda da válvula aórtica de provável natureza degenerativa (Fig. 3) sem outras anomalias valvulares morfológicas ou funcionais e sem dilatação das câmaras cardíacas. O ecocardiograma transesofágico (ETE) confirmou estes achados e permitiu a identificação de imagens filiformes móveis, a maior com 15 mm, na face ventricular da válvula aórtica sugestivas de vegetações (Fig. 4). O estudo serológico e microbiológico não permitiu a identificação de agentes de endocardite infeciosa. As hemoculturas foram negativas paraStreptococcus,Staphylococcus,Enterococcuse microorganismosHACEK (Haemophilussp.,Actinobacillus actinomycetem comitans,Cardiobacterium hominis,Eikenella corrodenseKingella kingae)e as serologias deCoxiella burnetii, Legionella pneumophila, Brucella, Bartonellasp. eBorrelia burgdorferiforam negativas. Considerando a estabilidade clínica e a melhoria da síndrome inflamatória com corticoterapia, o caso foi interpretado como ACG com ETNB associada. O restante estudo permitiu excluir outras doenças autoimunes (ANCAs, ANAs, anticorpo anti-dsDNA, fator reumatóide e estudo de síndrome antifosfolípidico negativos, ausência de consumo de complemento, níveis normais de imunoglobulinas) e neoplásicas (mamografia, ecografia da tiróide e estudos endoscópicos prévios recentes sem evidência de lesões suspeitas). A doente iniciou hipocoagulação com antagonista da vitamina K (AVK) pela FA e ETNB e beta-bloqueador para controlo da frequência cardíaca. Verificou-se resolução da clínica, apirexia sustentada e descida dos parâmetros inflamatórios. Após 1 ano de seguimento, a doente manteve-se sob corticóide em desmame (5 mg de prednisolona por dia) e AVK. Nesse momento apresentava-se assintomática, com parâmetros inflamatórios negativos (VS de 9mm/h e PCR de 0,4mg/L) e sem evidência de vegetações da válvula aórtica (Fig. 5), alterações funcionais valvulares ou da morfologia e tamanho das câmaras cardíacas em ETE. Realizou ainda Holter, em ambulatório, apresentando ritmo sinusal sem episódios de FA.
Este caso ilustra uma associação rara e pouco documentada na literatura de duas patologias. Apesar da biópsia arterial ser negativa, o que pode ser explicado pela corticoterapia concomitante ou por biópsia de porção de vaso não atingido pela inflamação, a clínica e os achados deecodopplerpermitiram o diagnóstico de ACG.⁹˒¹⁰ Por outro lado, a identificação da ETNB teve importantes implicações terapêuticas nomeadamente a hipocoagulação com enoxaparina ou AVK, uma vez que a eficácia dos anticoagulantes orais diretos neste cenário não está comprovada.³ O caso constitui mais um dado a favor de que a ACG possa envolver não só vasos de médio e grande calibre mas também estruturas cardíacas como as válvulas. A evidência do envolvimento de linfócitos T e macrófagos em lesões vasculíticas na ACG¹¹ e a sua presença em lesões de endocardite marântica fazem prever uma base fisiopatológica comum entre as duas patologias¹². Além disso, a etiologia da FA da doente permanece por esclarecer pela ausência de patologias que frequentemente se associam à arritmia como fatores de risco vascular, doença valvular significativa, cardiomiopatias, doença coronária e doença renal crónica. É possível que o quadro inflamatório sistémico decorrente da ACG tenha despoletado a FA mas não se pode excluir que esta doença tenha um efeito cardiotóxico mais direto. De fato, alguns meses depois do tratamento eficaz da arterite, a doente não apresenta episódios de FA em Holter. Eventos isquémicos podem ocorrer tanto na ACG por oclusão de vaso em contexto de vasculite como na ETNB por tromboembolismo. Assim, os autores questionam se alguns dos eventos isquémicos em doentes com ACG possam ser causados por ETNB não diagnosticada uma vez que nestes doentes não é feita, por rotina, a exclusão de vegetações endocardíticas. São necessários mais estudos para avaliar a consistência da relação entre as duas entidades com implicações diagnósticas, nomeadamente avaliação sistemática da presença de anomalias estruturais e funcionais cardíacas em doentes com ACG, e terapêuticas pela necessidade de associar a hipocoagulação à imunossupressão em doentes com ACG associada a ETNB.
Figura I
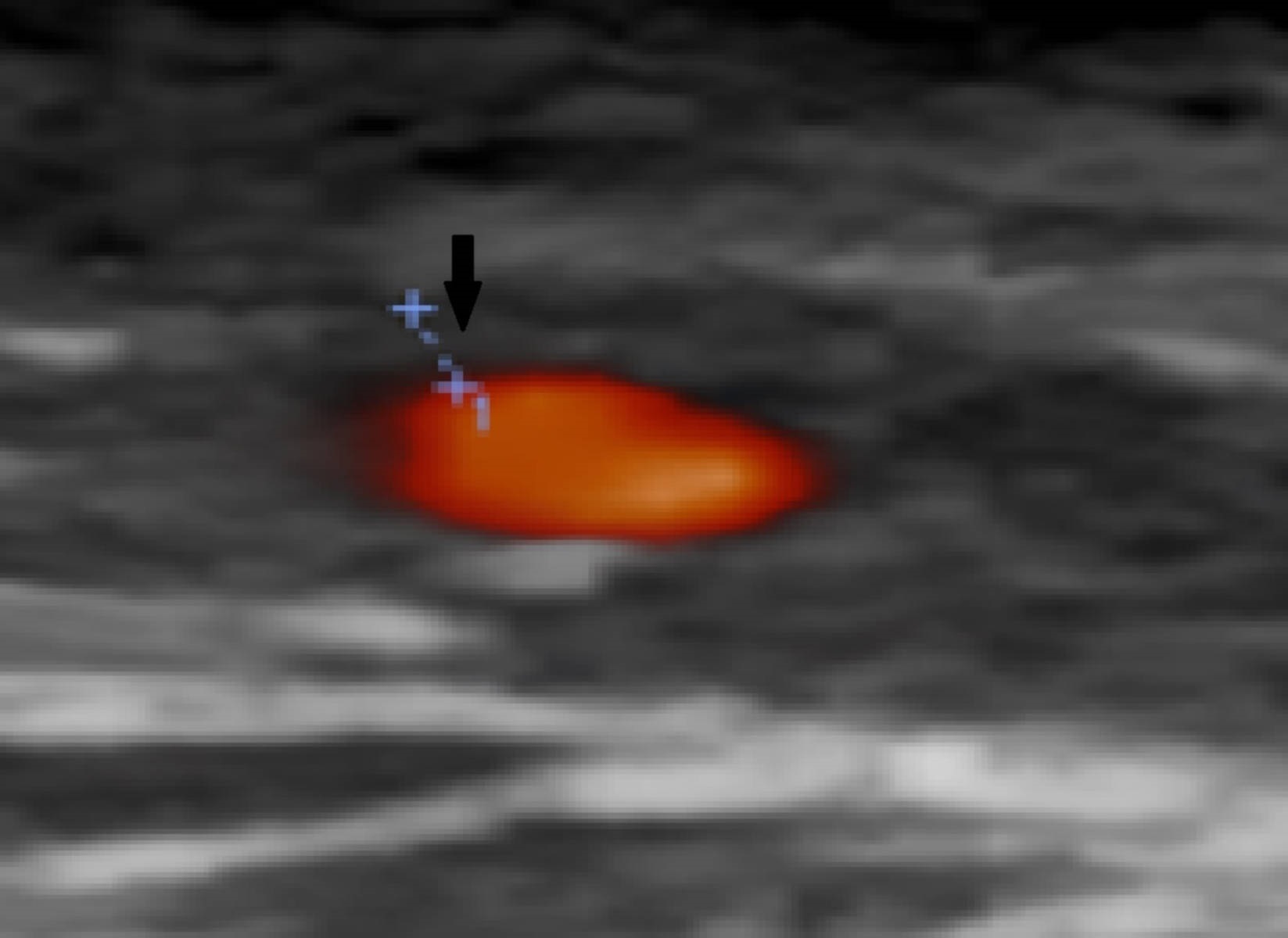
Halo hipoecogénico na parede da artéria temporal direita (seta preta)
Figura II
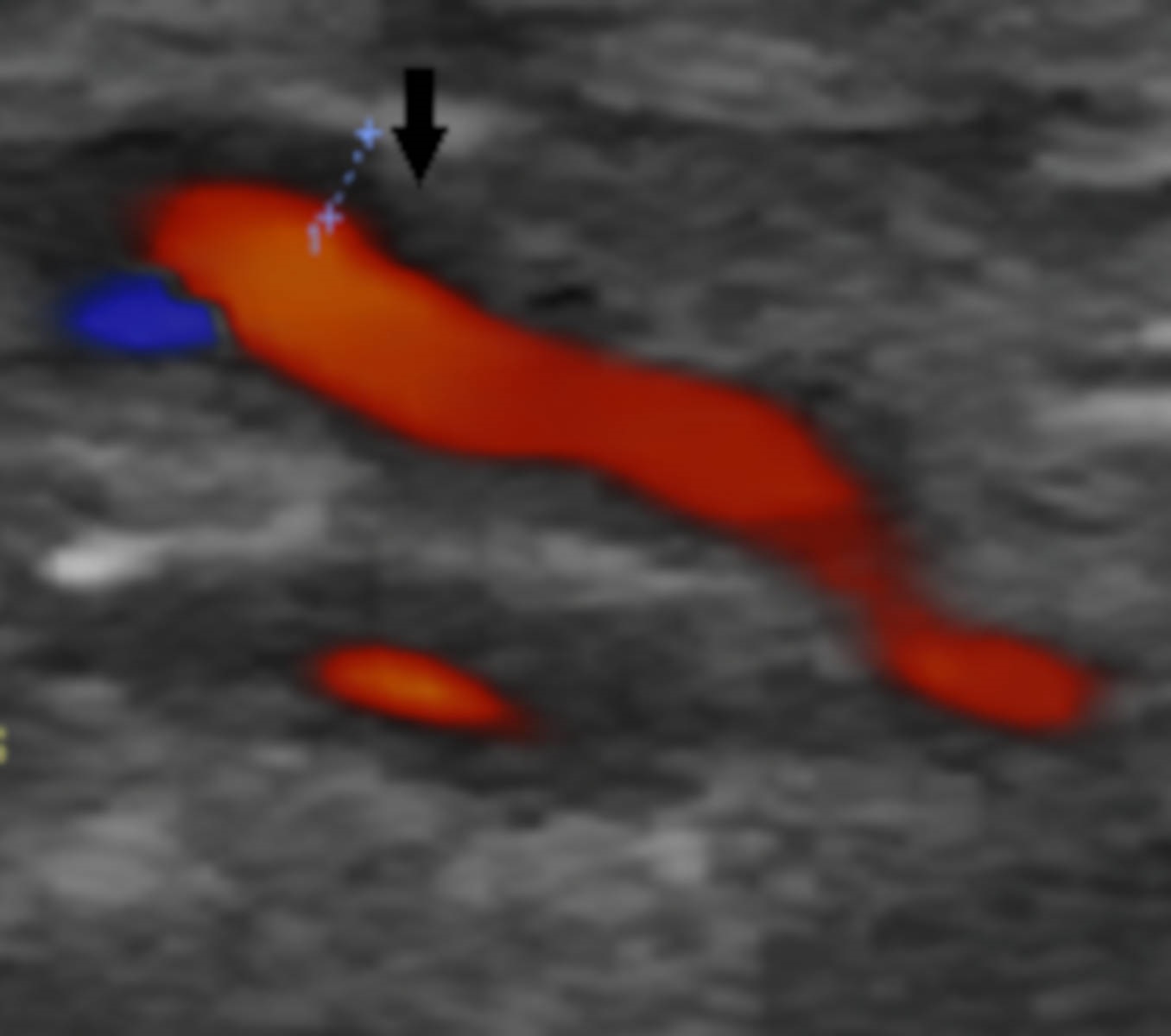
Halo hipoecogénico na parede da artéria temporal esquerda (seta preta)
Figura III
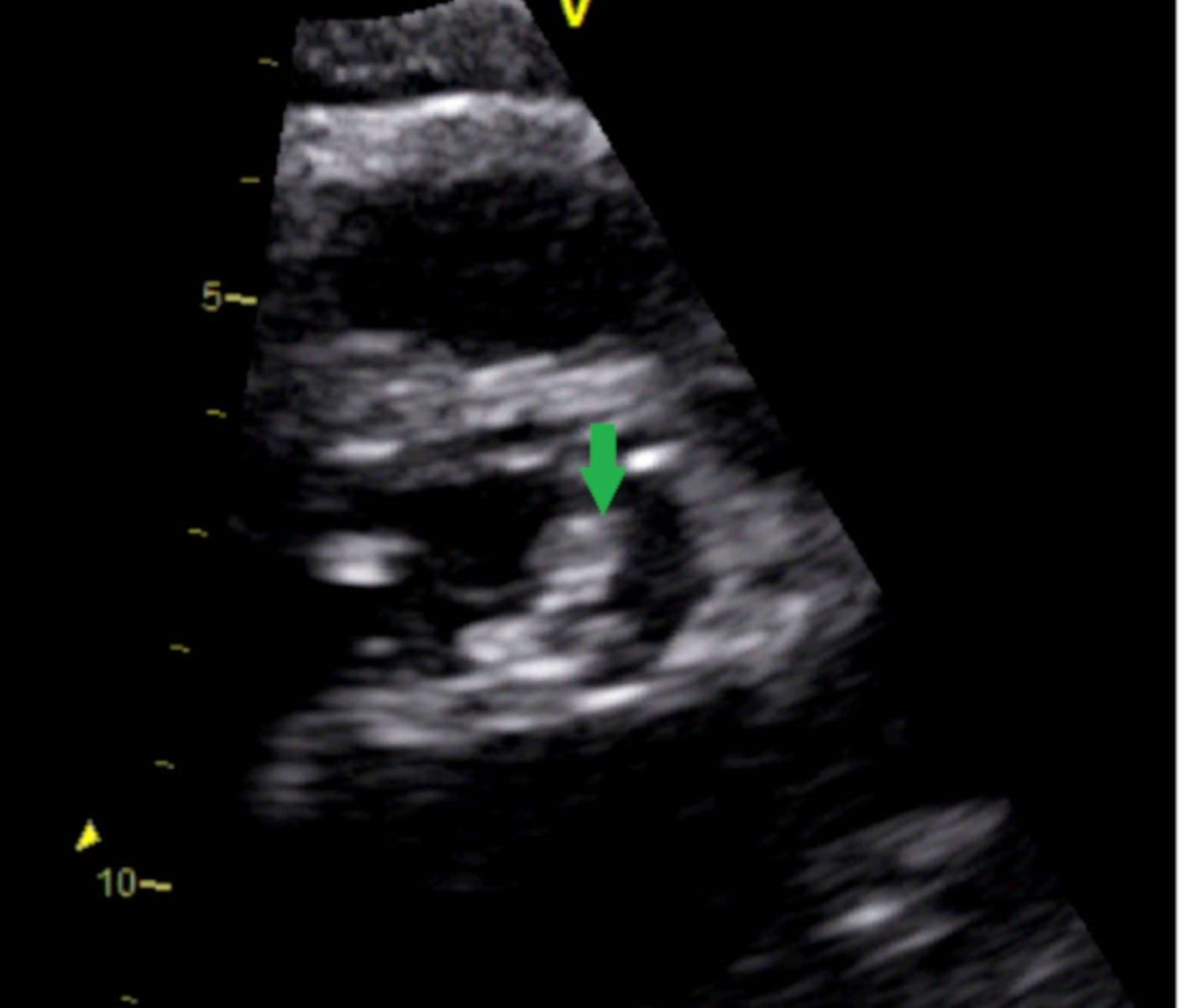
Lesão degenerativa na válvula aórtica em ecocardiograma transtorácico (seta verde)
Figura IV
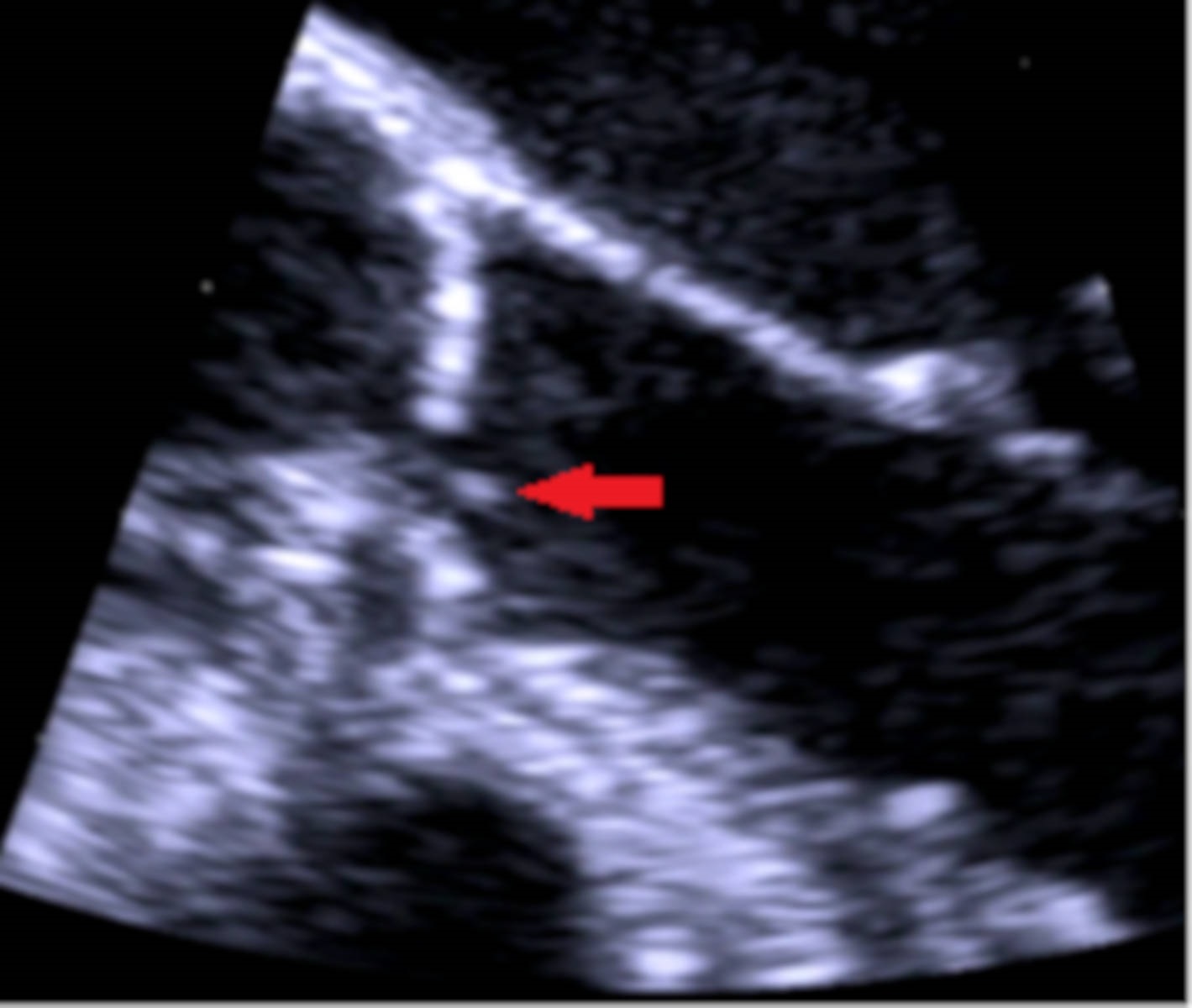
Imagem sugestiva de vegetação na válvula aórtica em ecocardiograma transesofágico (seta vermelha)
Figura V
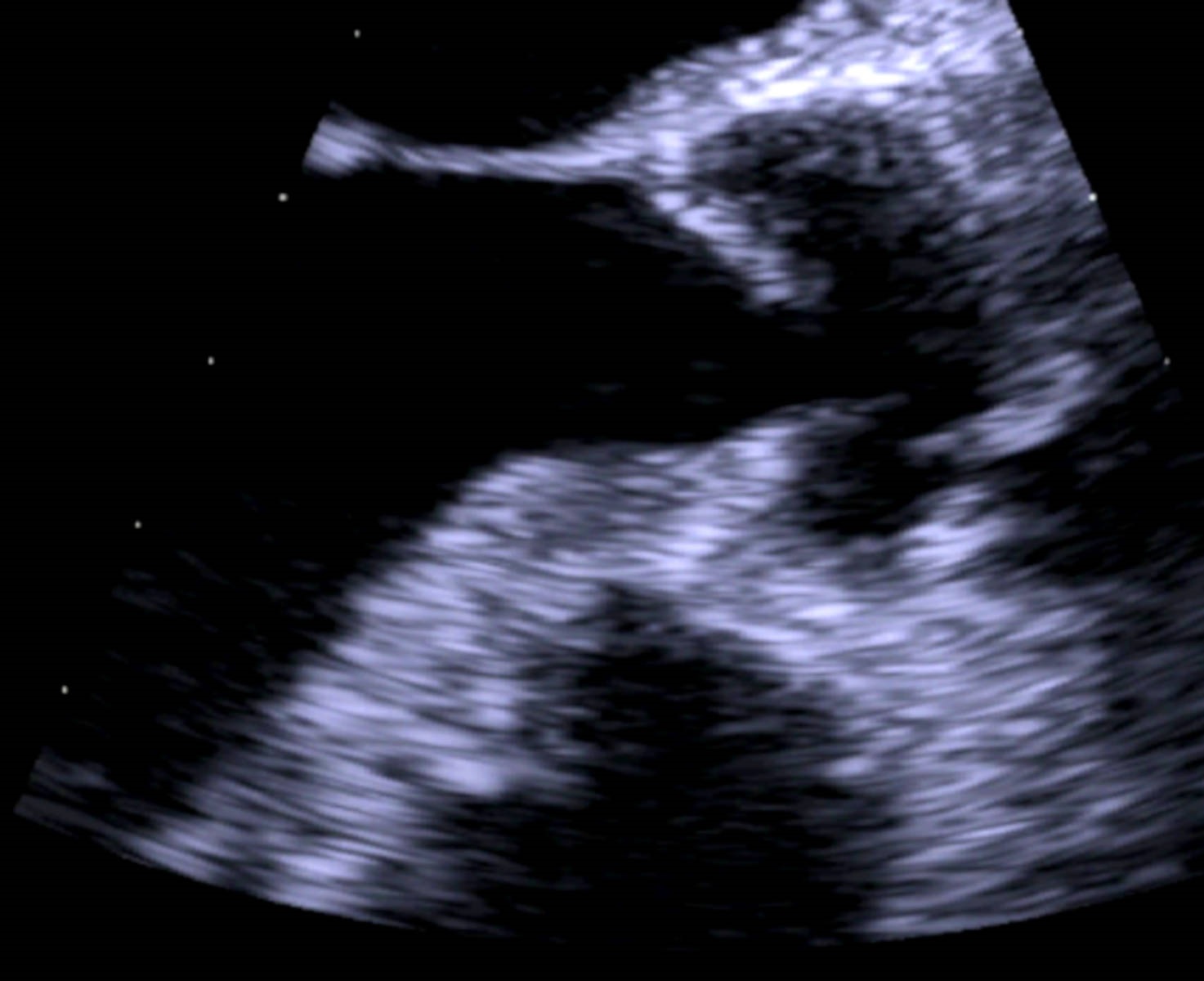
Ausência de vegetação na válvula aórtica em ecocardiograma transesofágico
BIBLIOGRAFIA
1. El-Shami K, Griffiths E, Streiff M. Nonbacterial thrombotic endocarditis in cancer patients: pathogenesis, diagnosis, and treatment. The oncologist. 2007; 12(5):518-23.
2. Roldan A,Sibbitt Jr L,Qualls R,Jung R, Greene E,Gasparovic C et al. Libman-Sacks endocarditis and embolic cerebrovascular disease. JACC Cardiovasc Imaging. 2013; 6(9):973-83.
3. Whitlock R, Sun J,Fremes S,Rubens F,Teoh K. Antithrombotic and thrombolytic therapy for valvular disease: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012; 141(2 Suppl):576-600.
4. Hesselink D,Klooster J,Schelfhout L,Scheffer M. Non-bacterial thrombotic (marantic) endocarditis associated with giant cell arteritis. Eur J Intern Med. 2001; 12(5):454–8.
5. Kopterides P, Moyssakis, Margos P, Sipsas N. Echocardiographic findings in patients with temporal arteritis: apropos of one case of temporal arteritis-associated verrucous (Libman-Sachs) endocarditis. Clin Exp Rheumatol 2006; 24(Suppl.41):35-7.
6. Terre A, Lidove O, Georges O, Mesnildrey P, Chennebault H, Ziza J. Non-infective endocarditis: expanding the phenotype of giant cell arteritis. Joint Bone Spine. 2019;86(1):115-6.
7. Ciofalo A, Gulotta G,Iannella G, Pasquariello B,Manno A,Angeletti Det al. Giant Cell Arteritis (GCA): Pathogenesis, Clinical Aspects and Treatment Approaches. Curr Rheumatol Rev. 2019;15(4):259-68.
8. Arida A, Kyprianou M, Kanakis M and Sfikakis P. The diagnostic value of ultrasonography-derived edema of the temporal artery wall in giant cell arteritis: a second meta-analysis. BMC Musculoskelet Disord. 2010;11:44.
9. Alberts MS, Mosen DM. Diagnosing temporal arteritis: duplex vs. biopsy. QJM. 2007; 100(12):785-9.
10. Diamantopoulos A,Haugeberg G,Hetland H,Soldal D,Bie R,Myklebust G. Diagnostic value of color Doppler ultrasonography of temporal arteries and large vessels in giant cell arteritis: a consecutive case series. Arthritis Care Res (Hoboken). 2014;66(1):113-9.
11. Weyand CM, Goronzy JJ. Giant-cell arteritis and polymyalgia rheumatica. Ann Intern Med 2003;139:505-15.
12. Oei FB, Stegmann AP, Van Der Ham F, Zondervan P, Vessen LMB, Baan CC et al. The presence of immune stimulatory cells in fresh and cryopreserved donor aortic and pulmonary valve allografts. J Heart Valve Dis 2002;11:315-24.






