INTRODUÇÃO
A Nefrite Tubulointersticial com Uveíte (TINU) caracteriza-se pela apresentação concomitante de inflamação intersticial aguda e uveíte anterior bilateral.1-3 Atualmente, já foram descritos mais de 300 casos,1 estimando-se que cerca de 2% dos doentes que recorrem a um centro especializado em uveítes é diagnosticado com TINU. A incidência é mais elevada no sexo feminino (numa proporção de 3:1), embora as últimas revisões demonstrem um aumento do número de casos em homens.4
Os mecanismos fisiopatológicos da TINU não são ainda bem conhecidos, tendo sido proposta uma interação entre uma base genética suscetível e um trigger ambiental, o qual precipita uma cascada autoimune.1,4 Foram identificados subtipos de antigénio de histocompatibilidade que poderão estar associados à perda da tolerância das células T: HLA-DQA1*01, HLA-DQB1*05 e HLA-DRB1*01.1,2,4 Os principais triggers para o desenvolvimento da doença incluem fármacos e tóxicos (anti-inflamatórios não esteróides, antibióticos e ervas de infusão chinesas)1,3-5 e causas infeciosas (vírusEpstein-Barr,Herpes zoster, toxoplasmose, tuberculose eChlamydia trachomatis).1,3,4
Os achados histopatológicos da biópsia renal incluem edema intersticial com infiltrado inflamatório (predomínio de células T, neutrófilos e plasmócitos) e lesão tubular, com edema, degeneração epitelial e necrose focal.1 Na maioria dos casos, a uveíte surge cerca de 3 meses após a nefrite intersticial, mas em 20% dos doentes, a clínica ocular precede a doença renal.5,6
Dada a raridade da doença, não existe ainda uma abordagem terapêutica devidamente validada. Quer a inflamação ocular, quer a renal parecem responder à corticoterapia sistémica, na fase aguda,1,7,8 embora a uveíte tenha uma taxa de recorrência de cerca de 50%.1,2Nestes casos, tem sido usada terapêutica imunossupressora, nomeadamente metotrexato, azatioprina, micofenolato de mofetil e ciclofosfamida, embora nenhum dos fármacos tenha demonstrado uma maior eficácia em relação aos demais.1,2,9-11 É necessário um acompanhamento prolongado do doente em consulta, de forma a prevenir futuras recaídas: a maioria dos casos reportados documentam uma duração média de tratamento entre 14,1 e 29,5 meses.7
Este caso ilustra o enorme desafio diagnóstico e terapêutico que a TINU pode representar, implicando uma abordagem multidisciplinar entre várias especialidades médicas como a Medicina Interna, Oftalmologia e Nefrologia.
CASO CLÍNICO
Apresentamos o caso de uma mulher de 51 anos com história pessoal de hipertensão arterial e dislipidémia.
A doente descrevia três episódios de hiperémia conjuntival bilateral nos últimos 5 meses, associados a fotofobia, lacrimejo e diminuição da acuidade visual. Em consulta de Oftalmologia, diagnosticou-se uveíte anterior aguda bilateral, tendo sido iniciada terapêutica tópica com corticoide e cicloplégicos, com significativa melhoria.
Concomitantemente, referia astenia significativa para esforços progressivamente menores, anorexia não seletiva e perda ponderal involuntária de cerca de 10% do seu peso total. Referia ainda náuseas, mialgias e “urina espumosa”(sic).
A doente residia em meio rural, com contacto próximo com cães e aves de capoeira. Consumia regularmente água de captação particular, sem monitorização da sua qualidade.
Tendo em conta o agravamento progressivo da situação clínica, recorreu ao Serviço de Urgência para avaliação.
Ao exame objetivo, encontrava-se normotensa e pesava 86kg (IMC: 32 kg/m2). Apresentava pele e mucosas pálidas e unhas quebradiças, assim como significativo edema simétrico dos membros inferiores (Fig. 1). Objetivava-se ainda hiperémia conjuntival bilateral, associada a dor ocular (Fig. 2).
A avaliação por Oftalmologia demonstrou diminuição da acuidade visual do olho direito (3/10), com hiperemia ciliar moderada bilateral e dusting endotelial. Câmara anterior com tyndall positivo bilateralmente e sinequias posteriores. Objetivava-se edema do disco ótico bilateralmente e lesões esbranquiçadas da retina interna. Assumiu-se o diagnóstico de panuveíte aguda bilateral.
Na avaliação analítica da urgência, destacava-se anemia normocítica normocrómica (Hemoglobina 8,3 g/dL), hipoalbuminémia (2,5 g/dL) e lesão renal aguda (Ureia 65 mg/dL e Creatinina 2,48 mg/dL).
A doente foi posteriormente admitida no Serviço de Medicina Interna para investigação.
O estudo da anemia sugeriu etiologia inflamatória, com níveis elevados de ferritina (429 ng/mL) e sem alterações dos restantes parâmetros de cinética do ferro, folato, vitamina B12 e esfregaço de sangue periférico. Verificou-se elevação dos parâmetros inflamatórios: velocidade de sedimentação >140 mm/1h e proteína C-reativa de 2,2 mg/dL. O exame sumário da urina documentou leucocitúria, glicosúria e discreta proteinúria (razão proteína/creatinina urinárias 1,05 mg/dL), a qual foi confirmada em urina de 24 horas (proteinúria de 420 mg/24h). Verificou-se elevação da β2-microglobulina sérica (10,55 mg/L) e urinária (530 ng/mL). A eletroforese de proteínas mostrou um pico de base alargada na fração gamma, com elevação da Imunoglobulina G total (2360 mg/dL). A imunofixação das proteínas no soro e urina era normal, com proteína de Bence-Jones negativa. O mielograma e biópsia óssea não evidenciaram alterações.
A ecografia renal documentou: “Rins de dimensões normais, contornos regulares e espessura parenquimatosa conservada, com normal diferenciação parênquimo-sinusal. Discreto aumento difuso da ecogenicidade parenquimatosa com ligeira proeminência das pirâmides, traduzindo eventual nefropatia médica incipiente” (Fig. 3).
O estudo da autoimunidade foi negativo (Tabela 1). A enzima conversora da angiotensina (ECA) estava discretamente elevada (77 U/L), mas não se evidenciaram outras manifestações sugestivas de Sarcoidose, nomeadamente hipercalciúria, patologia pulmonar ou adenopatias. Várias causas infeciosas com envolvimento ocular foram descartadas, nomeadamente sífilis, tuberculose VIH, hepatite B e C, toxoplasmose e herpes (Tabela1).
Tendo em conta a história de consumo de água de captação particular, foram realizados testes de qualidade à água que demonstraram que esta era “imprópria para consumo, dado o desenvolvimento de colónias de Citrobacter freundii”.
O caso foi discutido com Nefrologia, tendo-se realizado biópsia renal que evidenciou “difuso infiltrado inflamatório intersticial com predomínio de células mononucleares.” (Fig. 4)
Após exclusão de todas as outras causas, assumiu-se o diagnóstico de TINU e foi iniciada corticoterapia sistémica (prednisolona 1mg/kg/dia). Verificou-se significativa melhoria da inflamação ocular e progressiva normalização da função renal, pelo que a doente iniciou esquema de redução progressiva da dose de corticoide e teve alta hospitalar, mantendo seguimento em consulta.
Dois meses após alta, ocorreu um novo episódio de uveíte, associado a edema bilateral dos membros inferiores. Concomitantemente, verificavam-se efeitos adversos da corticoterapia sistémica, nomeadamente aumento do peso corporal (máximo de 115 kg), elevação da pressão arterial e hiperglicemia. Optou-se por associar terapêutica imunossupressora com metotrexato (15 mg/semanal), o que permitiu a redução progressiva de corticoterapia sistémica até à dose residual de 2,5 mg de prednisolona/dia.
Atualmente, cerca de 18 meses após o quadro inicial, a doente mantém seguimento regular nas consultas de Medicina Interna e Oftalmologia. Não se verificaram novas recidivas da doença e as avaliações oftalmológicas demonstram uma importante redução da inflamação ocular. Em análises clínicas seriadas, verifica-se normalização da função renal e resolução da anemia (Tabela 1).
DISCUSSÃO
Tal como demonstrado neste caso clínico, deve ser realizada uma extensa investigação etiológica antes de se assumir o diagnóstico de TINU, com a exclusão de possíveis causas neoplásicas, autoimunes e infeciosas.1,12
Neste caso em particular, a doente apresentava uveíte anterior bilateral que evoluiu posteriormente para panuveíte, associada ao desenvolvimento simultâneo de nefrite intersticial. Recentemente, os critérios classificatórios clássicos desta síndrome5foram revistos e validados.13Estes incluem a presença concomitante de uveíte anterior e evidência de nefrite tubulointersticial, quer pela demonstração de histologia renal positiva, quer pelas alterações laboratoriais típicas: elevação da creatinina sérica e alteração do sedimento urinário, com elevação da β2 microglobulina urinária.13Neste caso, os critérios chave estavam presentes e associavam-se a evidência de doença sistémica: astenia, anemia, perda ponderal e elevação dos parâmetros inflamatórios.2,5,13
Em retrospetiva, os autores colocam a hipótese de que uma infeção gastrointestinal a Citrobacter freundii poderia ter despoletado as manifestações clínicas, tendo em conta o consumo regular de água não vigiada por parte da doente. De facto, vários estudos têm proposto uma causa infeciosa como potencial trigger da doença,1,3,4 apesar de ser difícil estabelecer uma relação causal.
A TINU continua a ser uma entidade rara entre a população adulta, pelo que não existe ainda uma abordagem terapêutica validada. Neste caso, a estratégia baseou-se na consulta de vários casos clínicos e estudos retrospetivos. Alguns autores defendem a hipótese de uma recuperação espontânea da função renal sem necessidade de qualquer tratamento, apesar de a corticoterapia sistémica ser usada na maioria dos casos.1,7,14 Um estudo retrospetivo no Japão identificou 102 doentes com TINU, setenta e oito dos quais recebeu terapêutica corticoide. Quarenta e seis doentes tratados recuperaram completamente a função renal, mas em 16 dos 22 doentes que não receberam tratamento também se verificou normalização dos valores de creatinina.15
Relativamente à uveíte, a terapêutica tópica não é, em muitos casos, suficiente para reduzir a inflamação ocular, devendo ser associada corticoterapia sistémica.5,14 Tal como noutros casos semelhantes, verificou-se uma recidiva da doença ocular assim que se reduziu a dose de corticoides, pelo que foi iniciada terapêutica imunossupressora adjuvante com metotrexato, com bons resultados: foi possível reduzir progressivamente a dose de corticoide até doses residuais, sem evidência de novas recidivas.
Não existem, de igual forma, normas de orientação sobre o follow-up destes doentes.14,15 A doente mantém um seguimento regular nas consultas de Medicina Interna e Oftalmologia, com avaliações laboratoriais frequentes. Tal como no caso apresentado, as complicações intraoculares como o desenvolvimento de sinequias posteriores podem persistir em 21% dos doentes,15 pelo que é necessária uma vigilância oftalmológica regular.
Em conclusão, este caso clínico demonstra a importância de uma abordagem multidisciplinar em entidades provavelmente subdiagnosticadas como a TINU. É sem dúvida necessária mais investigação na área, de forma a validar normas de orientação e tratamento.
Quadro I
Avaliação laboratorial no momento da admissão e 5 meses após tratamento
| Parâmetro de avaliação | Admissão | 5 meses após tratamento | Valores de referência |
| | | | |
| Hemoglobina (g/dL) | 8,3 | 12,3 | 13-17 |
| Hematócrito (%) | 24,6 | 36,5 | 40-50 |
| Plaquetas (10^9/L) | 230 | 257 | 150-350 |
| Leucócitos (10^9/L) | 4,6 | 8,1 | 4,5-11,4 |
| Ureia (mg/dL) | 73 | 29,7 | 18-55 |
| Creatinina (mg/dL) | 2,7 | 0,95 | 0,7-1,25 |
| Albumina (g/dL) | 2,5 | 2,9 | 3,5-5,0 |
| Velocidade de sedimentação (mm/hora) | >140 | 16 | <30 |
| Proteína C-reativa (mg/dL) | 2,2 | 0,51 | <0,5 |
| Ferritina (ng/mL) | 429 | | 30-200 |
| Transferrina (mg/mL) | 197 | | 200-360 |
| Saturação de transferrina (%) | 30,5 | | 20-55 |
| Complemento C3 (mg/dL) | 137 | 160 | 90-180 |
| Complemento C4 (mg/dL) | 40,8 | 47,7 | 10-40 |
| Creatinina urinária (g/L) | 0,72 | 0,84 | 0,47-1,1 |
| Proteínas urinárias (g/L) | 0,76 | 0,08 | 0,01-0,14 |
| Enzima conversora da Angiotensina - ECA (U/L) | 77,4 | | 8-52 |
| ANA | Negativo | | |
| ENA´s | Negativo | | |
| Anti-dsDNA | Negativo | | |
| ANCA - PR3 e MPO (UI/mL) | Negativo | | |
| Fator Reumatóide | Negativo | | |
| Anti-MBG (UI/mL) | Negativo | | |
| Anti-nucleossoma | Negativo | | |
| Anti-ribossoma P | Negativo | | |
| HLA-B51 | Negativo | | |
| HLA-B27 | Negativo | | |
| Venereal Disease Research Laboratory (VDRL) | Negativo | | |
| Anticorpos Toxoplasma | IgM negativo/ IgG positivo | | |
| HIV1;HIV2 | Negativo | | |
| Antigénio HBs | Não reativo | | |
| Anticorpo anti-HBs | Negativo | | |
| Anticorpo anti-HBc | IgM e IgG Negativos | | |
| Anticorpos HCV | Negativo | | |
| Interferon Gamma Release Assay (IGRA) | Negativo | | |
Figura I
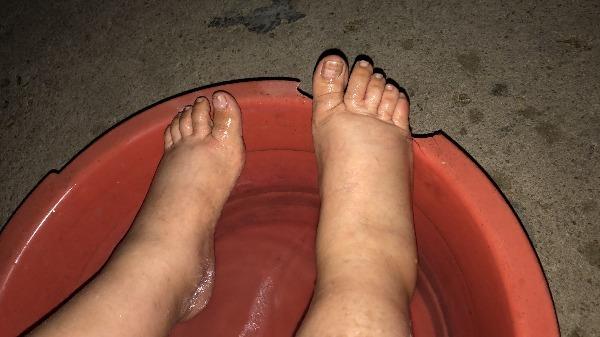
Figura 1: Edema simétrico dos membros inferiores
Figura II
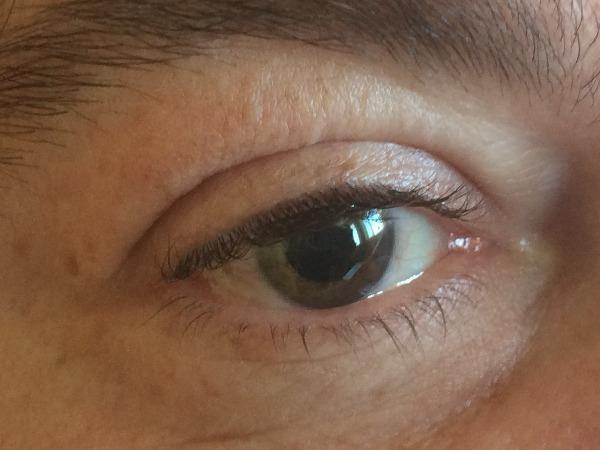
Figura 2: Uveíte anterior (em fase de resolução)
Figura III
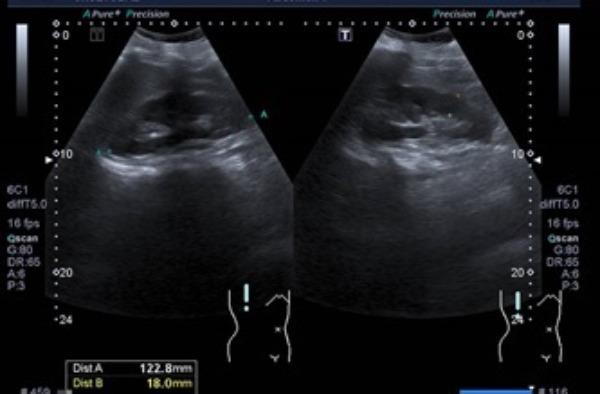
Figura 3: Ecografia renal evidenciando aumento difuso da ecogenicidade parenquimatosa com ligeira proeminência das pirâmides
Figura IV
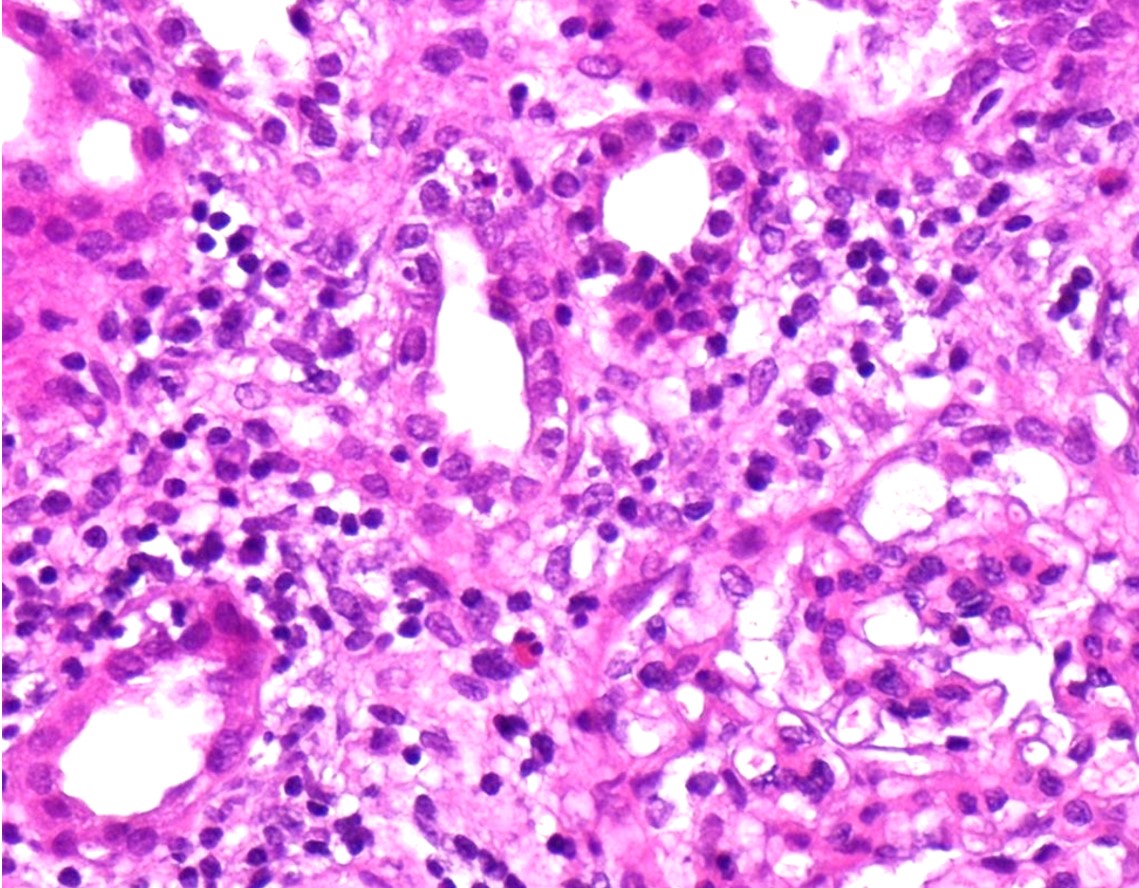
Figura 4: Exame histopatológico renal, evidenciando infiltrado inflamatório intersticial com predomínio de células mononucleares
BIBLIOGRAFIA
1. Amaro D, Carreño E, Steeples L R, Oliveira-Ramos F, Marques-Neves C, Leal I. Tubulointerstitial nephritis and uveitis (TINU) syndrome: a review. Br J Ophthalmol. 2020 Jun;104(6):742-7.doi: 10.1136/bjophthalmol-2019-314926.
2. Pakzad-Vaezi K, Pepple K. Tubulointerstitial Nephritis and Uveitis. Curr Opin Ophthalmol. 2017; 28(6): 629–35.
3. Okafor LO, Hewins P, Murray PI, et al. Tubulointerstitial nephritis and uveitis (TINU) syndrome: a systematic review of its epidemiology, demographics and risk factors. Orphanet Journal of Rare Diseases 2017; 12:128
4. Sinnamon KT, Courtney AE, Harron C, et al. Tubulointerstitial nephritis and uveitis (TINU) syndrome: epidemiology, diagnosis and management. NDT Plus 2008; 2: 112–6.
5. Mandeville JT, Levinson RD, Holland GN. The tubulointerstitial nephritis and uveitis syndrome. Surv Ophthalmol. 2001; 46:195–208.
6. Weinstein O, Tovbin D, Rogachev B, et al Clinical manifestations of adult tubulointerstitial nephritis and uveitis (TINU) syndrome. Int Ophthalmol. 2010; 30:621–628
7. Kanno H, Ishida K, Yamada W, et al. Clinical and Genetic Features of Tubulointerstitial Nephritis and Uveitis Syndrome with Long-Term Follow-Up. Journal of Ophthalmology 2018, 1-8
8. Caplasha S, Gangaputraa S, Kodatia S, et al. Treatment challenges in an atypical presentation of tubulointerstitial nephritis and uveitis (TINU). American Journal of Ophthalmology Case Reports 2018; 10: 253–6
9. Sobolewska B, Bayyoud T, Deuter C, et al. Long-term follow-up of patients with tubulointerstitial nephritis and uveitis (TINU) syndrome. Ocular Immunology and Inflammation 2016; 1–7.
10. Li C, Su T, Chu R, et al. Tubulointerstitial Nephritis with Uveitis in Chinese Adults. Clin J Am Soc Nephrol 2014; 9(1): 21–28.Sugiyama M. Measurement of urinary biomarkers in a case of tubulointerstitial nephritis and uveitis syndrome during glucocorticoid treatment. CEN Case Reports 2018; 7:221–4.
11. Agarwal R, Kanaujia V, Mishra P, Sharma K. Tubulointerstitial nephritis and uveitis syndrome: Our experience. Oman J Ophthalmol. 2020;13(2):89-91. Published 2020 May 28. doi:10.4103/ojo.OJO_56_2016
12. Arede Pedro B, Cordeiro M e Guedes M. Síndrome Nefrite Túbulo Intersticial Aguda e Uveíte (TINU): Um Distúrbio Óculo-Renal a Ser Considerado. Revista Sociedade Portuguesa de Oftalmologia 2021;45 (1):53-6.https://doi.org/10.48560/rspo.24120.
13. Standardization of Uveitis Nomenclature (SUN) Working Group. Classification Criteria for Tubulointerstitial Nephritis With Uveitis Syndrome. Am J Ophthalmol. 2021 Aug;228:255-61. doi: 10.1016/j.ajo.2021.03.041.
14.Anjum F. Koreishi , Mei Zhou & Debra A. Goldstein (2020): Tubulointerstitial Nephritis and Uveitis Syndrome: Characterization of Clinical Features, Ocular Immunology and Inflammation, DOI: 10.1080/09273948.2020.1736311
15. Matsumoto K. Fukunari K, Ikeda Y, et al. A report of an adult case of tubulointerstitial nephritis and uveitis (TINU) syndrome, with a review of 102 Japanese cases. Am J Case Rep 2015; 16: 119-23.





