INTRODUÇÃO
A necrose esofágica aguda (NEA), também conhecida como esófago negro ou esofagite necrotizante aguda, é uma entidade rara, caracterizada por uma pigmentação escura difusa do esófago na endoscopia alta, que corresponde, histologicamente, a necrose da mucosa do esófago.1-3 Na maioria dos casos, a necrose é circunferencial, afetando tipicamente o esófago distal, com interrupção abrupta a nível da junção gastroesofágica e extensão proximal variável.1,2
A fisiopatologia da NEA não é ainda inteiramente compreendida. Envolve geralmente uma combinação de vários mecanismos, incluindo isquemia esofágica, que surge habitualmente em contexto de compromisso hemodinâmico, lesão por refluxo de conteúdo gástrico e diminuição dos sistemas de barreira da mucosa, presente em estados de debilidade física ou malnutrição.1,4,5 A NEA ocorre mais frequentemente em homens de idade avançada com múltiplas comorbilidades.1,3,6,7 A apresentação clínica mais comum é a hemorragia digestiva alta (HDA), evidenciada por hematemeses e/ou melenas.1,6,7
Não existe tratamento específico para a NEA. A abordagem terapêutica consiste sobretudo em medidas de suporte e controlo das doenças subjacentes. A mortalidade global depende sobretudo das patologias ou comorbilidades subjacentes, podendo chegar aos 35%.1,3,7
CASO CLÍNICO
Apresentamos o caso de um homem de 58 anos, com antecedentes de hipertensão arterial (HTA), obesidade e osteoartrose, com consumo regular de anti-inflamatórios não esteróides (AINEs), internado no serviço de Medicina Interna por rabdomiólise e lesão renal aguda (LRA) multifatorial (provável necrose tubular aguda por pigmentos endógenos e toxicidade por AINEs). A investigação inicial reveloucreatinacinase (CK) 181.560 U/L, creatinina sérica (CrS) 5,0 mg/dL e ureia 90 mg/dL. Realizou inicialmente 2 sessões de hemodiálise, com posterior recuperação gradual da função renal. No 3º dia de internamento, desenvolveu disfagia para sólidos e líquidos. A videoendoscopia digestiva alta (EDA) mostrou alterações típicas de esófago negro/ necrose esofágica dos 2/3 inferiores do esófago, e duodenite erosiva (Fig. 1). Não foram efetuadas biópsias por má cooperação do doente. Iniciou inibidor da bomba de protões (IBP) por via endovenosa e ficou em pausa alimentar durante 24 horas, com melhoria clínica. No entanto, uma semana depois, apresentou subitamente HDA, com hematemeses, melenas e queda de hemoglobina para 9,4 g/dl. Repetiu EDA, que demonstrou necrose esofágica aguda em fase de resolução, com exposição de vasos submucosos e 3 pontos sangrantes no esófago médio (Fig. 2). Realizada hemostase com clip num dos pontos e injeção de solução de polidocanol a 1% nos restantes, sem sinais de hemorragia no final do prodedimento. Efetuou tomografia computorizada do tórax para exclusão de complicações agudas, que identificou espessamento parietal dos terços médio e distal do esófago e pneumatose mural, aspetos compatíveis com isquemia; sem pneumomediastino ou coleções líquidas periesofágicas. Manteve terapêutica com IBP e fluidos, ficou novamente em dieta zeroper ose realizou transfusão de 2 unidades de concentrado de eritrócitos (CE), com estabilização do valor de hemoglobina.
Teve alta após resolução da LRA, medicado com pantoprazol 40 mg / dia, apresentando CrS 1,0 mg/dL e CK 58 U/L. Mantém vigilância em consulta externa, mantendo-se assintomático sob IPB aos 9 meses de follow-up. Recusou a realização de EDA de controlo.
DISCUSSÃO
A NEA foi descrita primeiro em 19908e mais tarde sistematizada como uma síndrome própria1. Tem sido descrita como uma entidade rara, com uma prevalência de 0,01 a 0,28% em séries endoscópicas.5,9,10 No entanto, estima-se que a sua verdadeira prevalência possa estar subestimada, possivelmente devido a casos de apresentação subclínica e à regeneração espontânea e precoce após a isquemia transitória, o que pode levar à ausência dos aspetos típicos se a EDA for efetuada em momento mais tardio; e ainda devido a casos erroneamente diagnosticados como esofagite de refluxo.2,11 De facto, um estudo retrospetivo de doentes que realizaram endoscopia por HDA reportou uma prevalência de 6%,12 sugerindo uma maior incidência de NEA, sobretudo em doentes que se apresentam com HDA. Admite-se que uma maior consciencialização desta patologia conduza a maior taxa de deteção.2,11
A verdadeira etiologia da NEA mantém-se desconhecida: pensa-se que é multifatorial, com um mecanismo primordial de isquemia, evidenciado pelo maior compromisso do esófago distal, onde o órgão é menos vascularizado.1,10 A NEA surge sobretudo em homens de idade mais avançada e com fatores de risco vascular, como HTA e diabetes, ou evidência de doença coronária ou arterial periférica, quando se sobrepõe um compromisso hemodinâmico que leva a insuficiência vascular do esófago. A presença de comorbilidades como insuficiência cardíaca, doença pulmonar crónica, doença renal crónica, cirrose hepática ou neoplasias, torna estes doentes mais vulneráveis.1,6,7 Sobre este terreno favorável, a ocorrência de fatores precipitantes como choque de qualquer etiologia, sépsis, desidratação, hiperglicemia grave ou cetoacidose diabética, LRA ou intoxicação alcoólica aguda, pode desencadear a necrose esofágica1,6,7,13. Por outro lado, a ocorrência de obstrução da saída do estômago e refluxo do volumoso conteúdo gástrico para o esófago, favorecida em estados de debilidade e desnutrição, comprometem a circulação e os sistemas de barreira e reparação da mucosa a nível do esófago distal, sendo mecanismos adicionais da NEA.2,4,5 Num estudo, admitiu-se a implicação de AINEs na patogénese da NEA.12 No caso apresentado, podemos considerar um mecanismo isquémico associado a múltiplos fatores de risco (homem na 6ª década de vida, obeso, hipertenso), constituindo a LRA grave o evento agudo precipitante, possivelmente associado ao consumo de AINEs.
A HDA é a apresentação clínica mais comum da NEA, em até 90% dos casos, sendo o diagnóstico frequentemente um achado incidental da EDA.1,6,7 Outros sintomas de apresentação menos comuns incluem dor epigástrica, vómitos, disfagia e síncope.1,6,7 No caso descrito, a manifestação inicial da NEA foi disfagia, apesar de o doente ter desenvolvido hematemeses e melenas mais tardiamente, já apresentando então NEA em fase de recuperação. Assim, é de realçar a importância da valorização deste tipo de sintomas, menos específicos e alarmantes que a HDA, no diagnóstico do esófago negro, especialmente em doentes internados com patologias graves ou descompensadas.
A aparência endoscópica característica é habitualmente suficiente para estabelecer o diagnóstico2,3, mas a biópsia esofágica é recomendada sempre que possível, para exclusão de infeções locais (Candida albicans, citomegalovírus, vírus herpes simplex, Klebsiella pneumoniae) e para o diagnóstico diferencial com outras patologias esofágicas como melanoma maligno, melanocitose, pseudomelanose ou acantose nigricans.2,3 A ingestão de produtos cáusticos deve ser excluída pela história clínica. No caso do nosso doente, não foram realizadas biópsias devido à sua pouca tolerância ao exame.
Não existe tratamento específico para a NEA. A abordagem assenta na correção das doenças de base e em medidas de suporte. Inicialmente, deve incluir fluídoterapia, IBPs por via endovenosa, para prevenir lesão esofágica adicional causada pelo ácido gástrico, e pausa alimentar durante pelo menos 24 horas,2,3 sendo indicada a instituição de nutrição parentérica. A entubação nasogástrica é desaconselhada, pelo risco de perfuração,2,3 exceto em presença de obstrução gástrica ou vómitos persistentes.3 Em doentes com HDA condicionando anemia significativa, podem ser necessárias transfusões de CE. A antibioterapia empírica está recomendada em doentes selecionados, com suspeita de perfuração, descompensação clínica rápida, febre inexplicada ou imunossupressão.2 No caso do doente que apresentamos, as atitudes terapêuticas levaram a rápida melhoria. No entanto, desenvolveu posteriormente HDA, possivelmente devido à reintrodução demasiado precoce da alimentação oral, guiada pela resolução da disfagia e boa tolerância alimentar.
A perfuração esofágica é a mais grave complicação aguda da NEA, ocorrendo em 3,5% a 7% dos doentes,1,6,7 levando a mediastinite, abcesso mediastínico ou empiema, em geral requerendo cirurgia emergente. A longo prazo, a complicação mais comum é a estenose esofágica, que ocorre em cerca de 9% dos doentes,6,7 podendo atingir 25% em séries pequenas.10,13 Esta complicação pode ser tratada endoscopicamente através de dilatação por balão. Assim, e com o objetivo de prevenir a formação de estenoses, é recomendado manter IBP durante alguns meses.2,3
Historicamente, a NEA associa-se a prognóstico reservado, com uma mortalidade global de até 35%.1,6,7 O prognóstico depende maioritariamente da situação clínica subjacente e das comorbillidades dos doentes, sendo a mortalidade atribuída diretamente à NEA de apenas 6%.1 Com tratamento de suporte, a resolução das lesões esofágicas ocorre ao fim de duas semanas na maioria dos casos.1,2 Mesmo nos casos com evolução favorável, é recomendada a reavaliação endoscópica dentro de 1 mês, para documentar a resolução da NEA e despistar a presença de complicações tardias,1,3 embora possa ser legítima a repetição apenas perante sintomas sugestivos, como disfagia ou dor torácica9. No caso descrito, o doente evoluiu favoravelmente com a instituição das medidas de suporte e o tratamento das doenças de base, nomeadamente da LRA. A avaliação endoscópica não foi repetida por recusa do doente. No entanto, mantém terapêutica com IBP sem recorrência de sintomas.
CONCLUSÃO
A NEA é uma entidade rara, que deve ser considerada no diagnóstico diferencial de doentes com comorbilidades significativas, debilitação do estado geral e/ou idade avançada. Embora a HDA seja a manifestação mais comum, a disfagia pode ser o sintoma de apresentação. A NEA é uma doença grave e potencialmente fatal, cujo prognóstico depende maioritariamente da gravidade das comorbilidades subjacentes e fatores precipitantes. Contudo, o tratamento de suporte e correção das doenças subjacentes permite a recuperação da maioria dos doentes.
Figura I
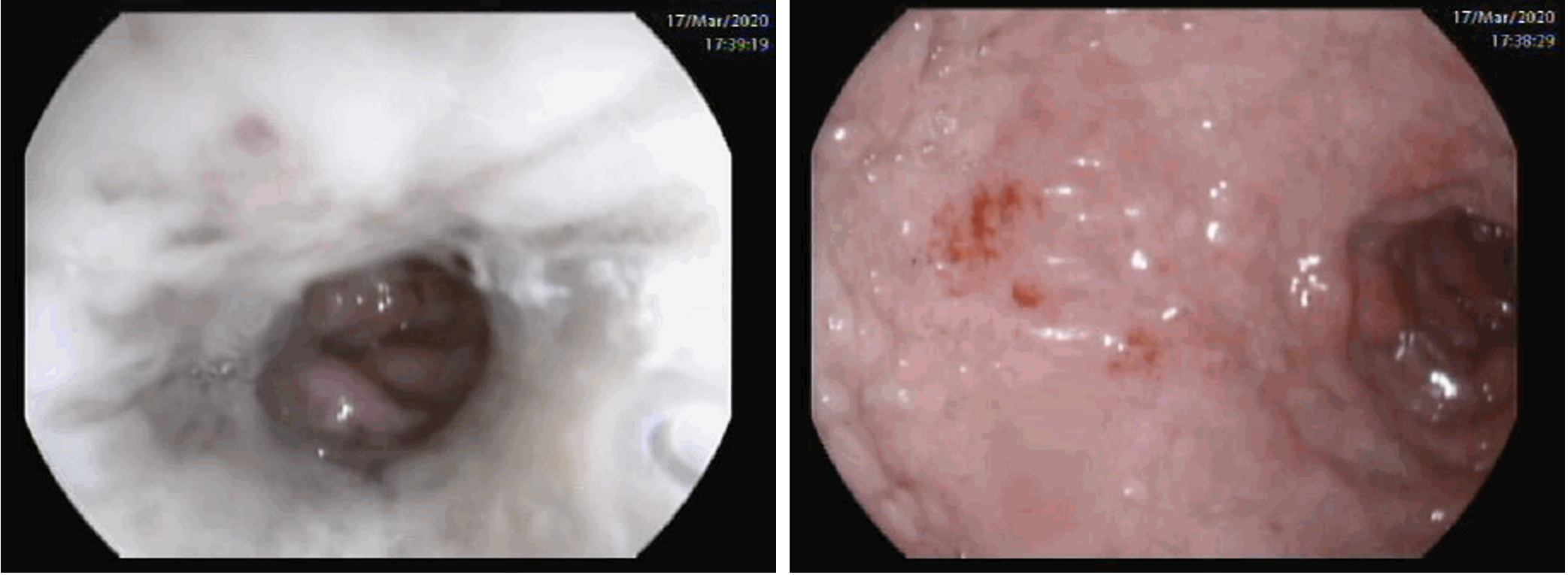
Videoendoscopia digestiva alta mostrando necrose esofágica circunferencial dos 2/3 inferiores do esófago, compatível com o diagnóstico de esófago negro.
Figura II
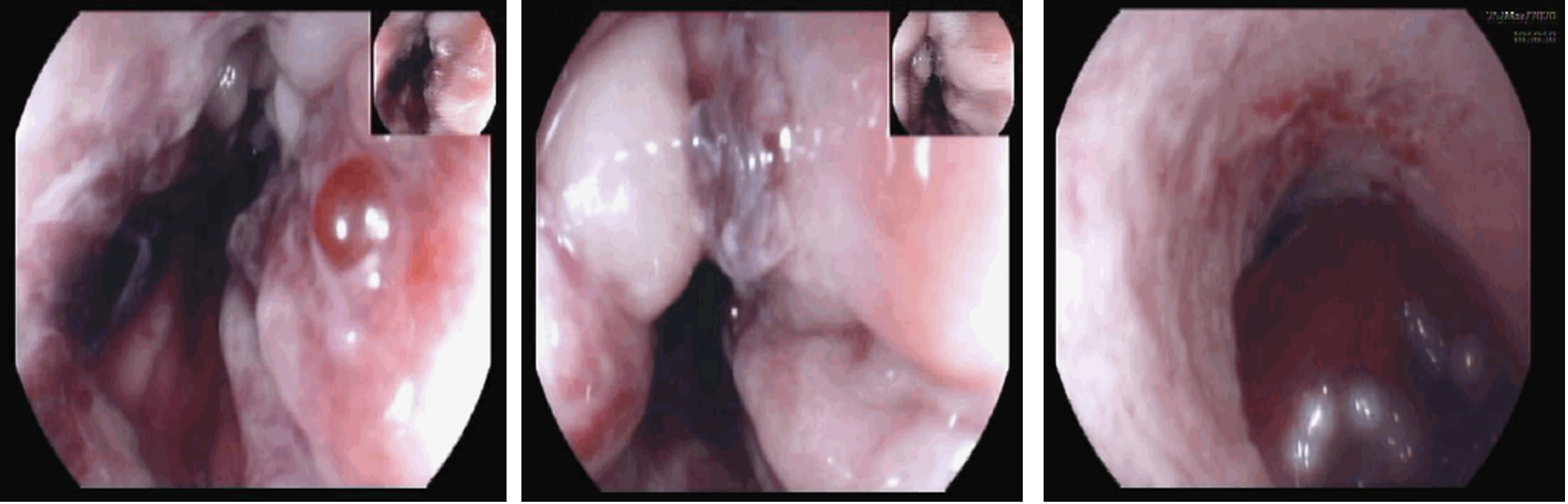
Videoendoscopia digestiva alta realizada uma semana após o diagnóstico - necrose esofágica aguda em fase de resolução, com exposição de vasos submucosos e hemorragia ativa no esófago médio
BIBLIOGRAFIA
1. Gurvits GE, Shapsis A, Lau N, Gualtieri N, Robilotti JG. Acute esophageal necrosis: a rare syndrome. J Gastroenterol. 2007; 42: 29-38. DOI: 10.1007/s00535-006-1974-z.
2. Gurvits GE. Black esophagus: Acute esophageal necrosis syndrome. World J Gastroenterol. 2010;16(26):3219–25. DOI: 10.3748/wjg.v16.i26.3219
3. Dias E, Santos-Antunes J, Macedo G. Diagnosis and management of acute esophageal necrosis. Ann Gastroenterol. 2019; 32(6):529–40. DOI: 10.20524/aog.2019.0418
4. Orlando RC. Pathogenesis of the gastroesophageal reflux disease. Am J Med Sci. 2003; 326: 274-8. DOI: 10.1097/00000441-200311000-00003
5. Ben Soussan E, Savoye G, Hochain P, Hervé S, Antonietti M, Lemoine F, et al. Acute esophageal necrosis: A 1-year prospective study. Gastrointest Endosc. 2002; 56(2):213–7. DOI: 10.1016/s0016-5107(02)70180-6.
6. Schizas D, Theochari NA, Mylonas KS, Kanavidis P, Spartalis E, Triantafyllou S, et al. Acute esophageal necrosis: A systematic review and pooled analysis. World J Gastrointest Surg. 2020; 12(3):104–15. DOI: 10.4240/wjgs.v12.i3.104
7. Abdullah HM, Ullah W, Abdallah M, Khan U, Hurairah A, Atiq M. Clinical presentations, management, and outcomes of acute esophageal necrosis: a systemic review. Expert Rev Gastroenterol Hepatol. 2019; 13(5):507–14. DOI: 10.1080/17474124.2019.1601555.
8. Goldenberg SP, Wain SL, Maignani P. Acute necrotizing esophagitis. Gastroenterol 1990; 98:493-6. DOI: 10.1016/0016-5085(90)90844-q.
9. Augusto F, Fernandes V, Cremers MI, Oliveira AP, Lobato C, Alves AL, et al. Acute necrotizing esophagitis: A large retrospective case series. Endoscopy. 2004; 36(5):411–5. DOI: 10.1055/s-2004-814318.
10. Moretó M, Ojembarrena E, Zaballa M, Tánago JG, Ibánez S. Idiopathic acute esophageal necrosis: not necessarily a terminal event. Endoscopy. 1993; 25(8):534–8. DOI: 10.1055/s-2007-1009121.
11. Julian Gómez L, Barrio J, Atienza R, Fernández-Orcajo P, Mata L, Saracíbar E, et al. Acute esophageal necrosis: An underdiagnosed disease. Rev Española Enfermedades Dig. 2008; 100(1):29–34. DOI: 10.4321/s1130-01082008001100006.
12. Yasuda H, Yamada M, Endo Y, Inoue K, Yoshiba M. Acute necrotizing esophagitis: Role of nonsteroidal anti-inflammatory drugs. J Gastroenterol. 2006; 41(3):193–7. DOI: 10.1007/s00535-005-1741-6.
13. Gurvits GE, Cherian K, Shami MN, Korabathina R, El-Nader EMA, Rayapudi K, et al. Black Esophagus: New Insights and Multicenter International Experience in 2014. Dig Dis Sci. 2015; 60(2):444–53. DOI: 10.1007/s10620-014-3382-1.



