Introdução
A tuberculose continua a ser um problema de saúde pública a nível mundial, ocupando a 2ª posição dentro das causas infeciosas de morte em adultos1. Segundo a Organização Mundial de Saúde, a cada ano ocorrem aproximadamente 10 milhões de novos casos e cerca de 1,5 milhões de mortes1. Embora o número de casos tenha vindo a descer nos últimos anos, Portugal ainda ocupa um dos primeiros lugares nos países com maior taxa de incidência dentro da União Europeia (16,5 por 100.000 habitantes em 2019)2.
A tuberculose pulmonar continua a ser a forma mais frequente da doença, mas qualquer órgão ou sistema pode ser afetado, incluindo o sistema nervoso central (SNC). A tuberculose do SNC é uma das formas mais graves da doença e está associada a uma alta morbimortalidade. Corresponde a 1-5% dos casos de tuberculose e 10% dos casos na população com infeção pelo vírus da imunodeficiência humana (VIH)3,4. Divide-se em três apresentações principais: meningite tuberculosa, tuberculoma e abcesso tuberculoso5.
Os fatores de risco para desenvolvimento de tuberculose do SNC incluem pobreza, aglomerados populacionais, má nutrição, idades extremas, infeção VIH, neoplasias, terapêutica imunossupressora, diabetes mellitus e alcoolismo4,6,7,8,9.
Caso clínico
Doente do sexo feminino, 46 anos, natural e residente na Guiné-Bissau; história de infeção VIH-2, diagnóstico durante a gravidez em 2005, sob terapêutica antirretrovírica (TARV) desde 2015, em seguimento na Guiné-Bissau, desconhecendo-se o estadiamento imunológico; medicada com Lamivudina 150mg+Zidovudina 300mg+Lopinavir 200mg+Ritonavir 50mg bid. Recorreu ao serviço de urgência por queixas de cefaleia hemicraniana esquerda, que evoluiu para holocraniana, de aparecimento insidioso e agravamento progressivo com 4 meses de evolução, acompanhada de anorexia não seletiva com perda ponderal de 8 kg.
Ao exame objetivo, a doente encontrava-se vígil, orientada e sem défices focais. Anaticamente com anemia normocítica normocrómica (Hb 11,8 g/dL) e discreta elevação da proteína C reativa (1,9 mg/dL). Realizou tomografia computorizada (TC) cranioencefálica que revelou hipodensidade parietal parassagital esquerda com redução da amplitude dos sulcos contíguos e eventual hipodensidade da substância branca cerebelosa direita (imagens 1-2). A ressonância magnética (RMN) crânioencefálica mostrou três lesões expansivas intra-axiais; área lesional esferóide subcortical parietal esquerda, com cerca de 15 mm de diâmetro, hiperintensa em DP e T2/FLAIR, com edema vasogénico; área lesional hemisférica cerebelosa superior direita, heterogénea, com duas lesões com 12 e 10 mm de diâmetro, hiperintensas em T2 e FLAIR, com efeito de massa, condicionando colapso parcial do IV ventrículo, desviado para a esquerda; padrão de captação de tipo anelar em ambas as lesões após injecção de contraste (imagens 3-6).
Foi colocada a hipótese diagnóstica de toxoplasmose cerebral e a doente iniciou Sulfadiazina e Pirimetamina. O estadiamento imunológico revelou uma contagem de linfócitos T CD4 858 células e carga viral VIH-2 indetetável, o que excluiu a suspeita de toxoplasmose. Foi admitido o diagnóstico de neurocisticercose e instituída terapêutica com Albendazol e Prednisolona, que a doente cumpriu durante 14 dias, com evolução favorável das queixas.
Dois meses após a alta, a doente retorna ao serviço de urgência por recrudescência da cefaleia. Repetiu TC crânioencefálica que revelou discreto aumento das dimensões e edema das lesões cerebrais já conhecidas; RMN com discreto aumento dimensional da lesão parietal posterior esquerda, com maior edema vasogénico perilesional, condicionando maior apagamento sulcal e maior moldagem do corno e átrio do ventrículo lateral esquerdo; aumento dimensional das lesões hemisféricas cerebelosas laterosuperiores direitas e do edema perilesional, que condicionavam desvio interno do pedúnculo cerebeloso superior homolateral.
Realizou TC toracoabdominopélvica que revelou múltiplas formações ganglionares nas cadeias abdominais superiores, lombo-aórticas e mesentéricas. Punção lombar com líquor de aspeto límpido, 19 células/µL com predomínio de polimorfonucleares, proteínas 71,5 mg/dL, glicose 71 mg/dL (sérica 92 mg/dL), ADA não solicitado; exame direto, bacteriológico, micológico e parasitológico negativos; pesquisa de PCR para BK, VDRL, Toxoplasma, Cryptococcus e Epstein-Barr negativas; citologia negativa para pesquisa de células neoplásicas. IGRA negativo. Sem sinais de hipertensão intracraniana.
Ao 15º dia de internamento a doente foi transferida para a Neurocirurgia para realização de biópsia de biópsia estereotáxica da lesão intracraniana; procedimento e período pós-operatório sem intercorrências. A biópsia identificou infiltrado linfohistocítico com granulomas epitelióides e células gigantes multinucleadas, com extensa necrose, sugestivo de infeção por micobactérias. Não se identificaram bacilos álcool-ácido resistentes ao exame direto, mas isolou-se Mycobacterium tuberculosis multissensível no exame micobacteriológico.
A doente iniciou terapêutica quadrúpla com Isoniazida, Rifabutina, Etambutol e Pirazinamida. Verificou-se melhoria clínica progressiva com desaparecimento das queixas de cefaleias. Teve alta referenciada ao Centro de Diagnóstico Pneumológico para vigilância clínica em ambulatório.
Conclusão
O homem é o único reservatório conhecido de Mycobacterium tuberculosis. O contágio ocorre através da inalação de partículas aerossolizadas para os alvéolos pulmonares. Durante a infeção primária ocorre disseminação hematogénica que permite aos bacilos alcançarem localizações extrapulmonares, incluindo o cérebro3. Pode ocorrer doença simultaneamente em várias localizações, a existência de adenopatias identificadas na TC sugere que possa haver envolvimento ganglionar.
O tuberculoma é uma lesão granulomatosa com necrose caseosa central, rodeada por linfócitos, histiócitos e células gigantes de Langhans, comummente associada a edema perilesional. Em adultos, a maioria dos tuberculomas tem uma localização supratentorial, sendo os lobos frontal e parietal os mais afetados4. Os tuberculomas podem ser solitários ou múltiplos10.
A clínica depende maioritariamente do tamanho e localização das lesões. Convulsões, hemiparesia, défices neurológicos focais e sinais de hipertensão intracraniana podem ocorrer, mas os principais sintomas são inespecíficos, como cefaleia, náuseas, vómitos, febre e perda ponderal11. A sintomatologia pode desenvolver-se ao longo de várias semanas a meses5. Pode haver envolvimento simultâneo com meningite tuberculosa em cerca de 10% dos casos7.
O diagnóstico pode ser feito com base em elementos clínicos, epidemiológicos, analíticos, imagiológicos e histológicos. Os exames laboratoriais podem revelar alterações como leucocitose e anemia ligeira8. O IGRA pode ser negativo, particularmente em doentes VIH7, como se observou no caso clínico. Todos os doentes devem realizar radiografia torácica que pode mostrar alterações parenquimatosas ou padrão miliar8. O exame citoquímico do líquido cefalorraquidiano (LCR) é o gold standard para o diagnóstico de meningite tuberculosa; no caso de tuberculoma pode ser normal ou apresentar uma discreta hiperproteinorráquia4, o exame micobacteriológico do LCR é geralmente negativo5.
A TC e RMN crânioencefálicas são essenciais ao diagnóstico, embora não hajam sinais imagiológicos patognomónicos. Os tuberculomas apresentam-se como lesões sólidas, de forma arredondada ou oval, iso ou hiperdensas na TC, com realce em anel após administração de contraste12, e associadas frequentemente a edema perilesional5.
A RMN é mais sensível que a TC para deteção de lesões6. As características imagiológicas diferem entre tuberculomas não caseosos e caseosos, com material líquido ou sólido no centro da lesão4,5. Os granulomas caseosos sólidos são hipo ou isointensos em T1 e T212. Por outro lado, as lesões não caseosas são hipointensas em T1 e hiperintensas em T212. Ambas as lesões têm realce e marcado edema perilesional após administração de contraste4.
O diagnóstico definitivo exige o isolamento de Mycobacterium tuberculosis em exame cultural, que permite adicionalmente testar a sensibilidade do microorganismo aos antibacilares. A biópsia da lesão está indicada para confirmação do diagnóstico quando este é incerto5.
O diagnóstico diferencial inclui lesões ocupando espaço do SNC, como neoplasias primárias ou metástases, neurocisticercose, toxoplasmose e neurosarcoidose entre outras4,5,13. Esta diferenciação é difícil com base apenas na clínica e exames de imagem.
O tratamento da tuberculose, independentemente da localização, inclui esquemas longos e com múltiplos fármacos. Não existem ensaios clínicos dedicados à investigação do esquema mais eficaz para a tuberculose do SNC, nem quanto à duração mais adequada5. As recomendações da Direção Geral da Saúde (DGS)14 sugerem um esquema inicial quadrúplo com Isoniazida, Rifampicina, Pirazinamida e Etambutol durante 2 meses, seguido de manutenção com Isoniazida e Rifampicina durante 10 meses6,7.
Na coinfeção VIH o tratamento segue os mesmos princípios. Nos doentes sem TARV deve protelar-se o seu início pelo risco de síndrome de reconstituição imunológica7,14. Em doentes sob TARV esta deve ser mantida mas pode ser necessário ajustar doses ou substituir fármacos, tendo em conta as interações medicamentosas que podem cursar com toxicidade e falência virológica7. Em doentes medicados com inibidores da protease, como no caso, a Rifampicina deve ser substituída por Rifabutina 150mg.
Atualmente temos disponíveis esquemas de TARV mais cómodos e seguros; privilegiando-se a associação de inibidores nucleosídeos da transcriptase reversa com inibidores da integrase. As formulações em toma única diária favorecem a adesão e tolerabilidade.
A corticoterapia adjuvante está recomendada no tratamento da tuberculose do SNC, particularmente nos casos que cursam com aumento da pressão intracraniana, marcado edema perilesional e hidrocefalia6,8. O tratamento cirúrgico deve ser reservado para complicações5.
A taxa de mortalidade da tuberculose do SNC pode atingir os 50%6, maior nos casos de meningite tuberculosa. O prognóstico depende principalmente do estadio da doença à data do diagnóstico. O tratamento deve ser iniciado o mais precocemente possível quando a suspeita clínica é forte e, não deve ser nunca atrasado pela ausência de resultados micobacteriológicos, para evitar complicações e sequelas neurológicas8.
Dada a inespecificidade da clínica, a dificuldade no diagnóstico e a elevada morbimortalidade, a tuberculose do SNC exige uma elevada suspeição clínica e intervenção rápida. A tuberculose é a doença definidora de SIDA mais comum15, e é 5 vezes mais frequente em doentes com VIH do que na população geral5.
Figura I
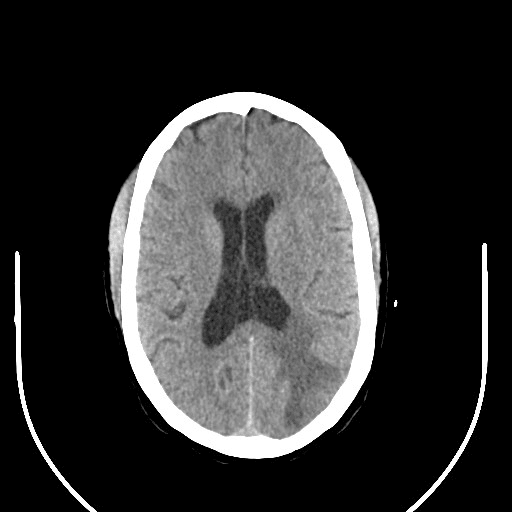
Hipodensidade parietal esquerda em TC-CE
Figura II
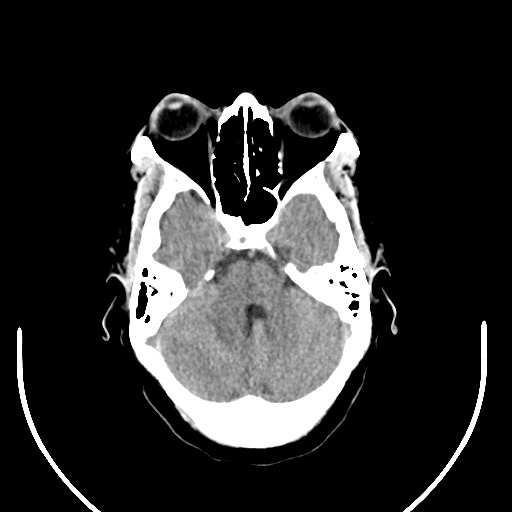
Hipodensidade cerebelosa direita em TC-CE
Figura III
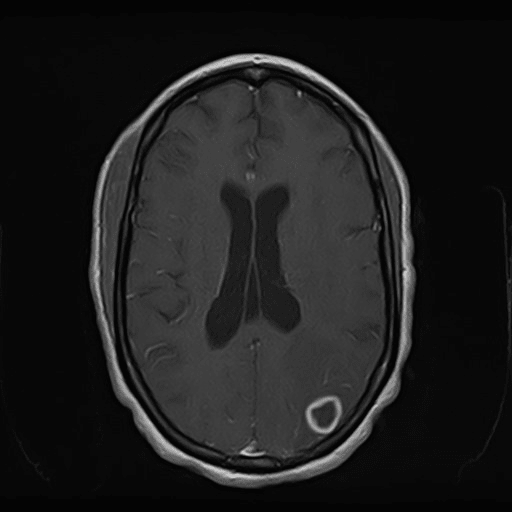
Lesão parietal esquerda em ressonância magnética T1 após administração de gadolíneo
Figura IV
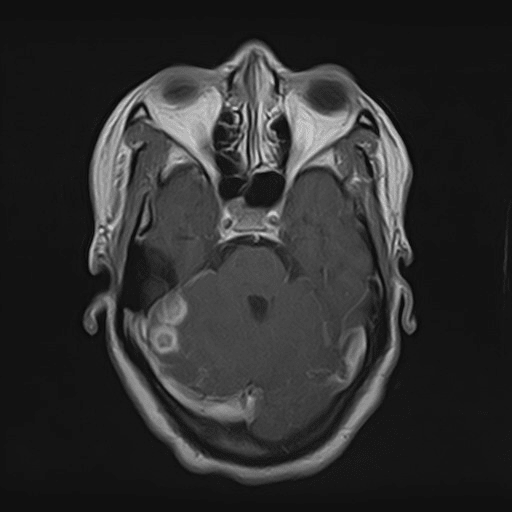
Lesões cerebelosas direitas em ressonância magnética T1 após administração de gadolíneo
Figura V
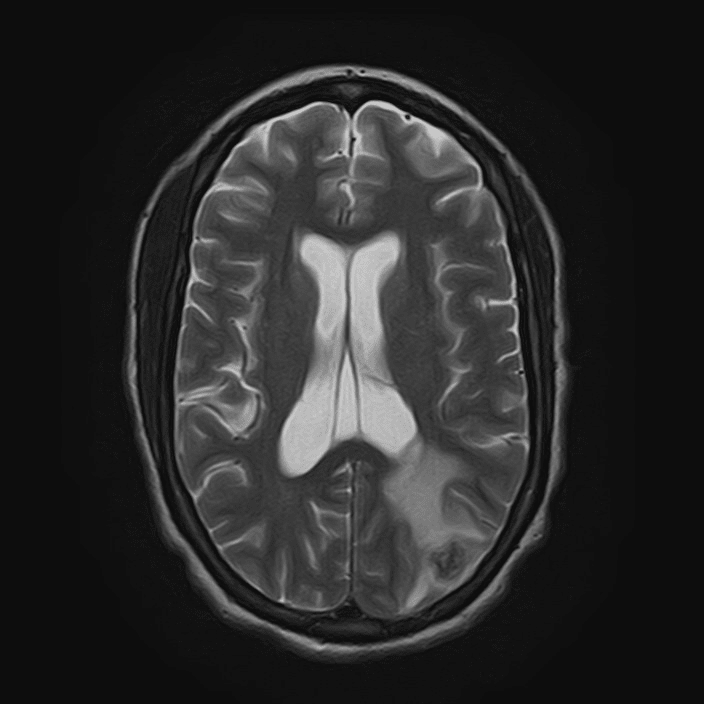
Lesão parietal esquerda em ressonância magnética T2
Figura VI
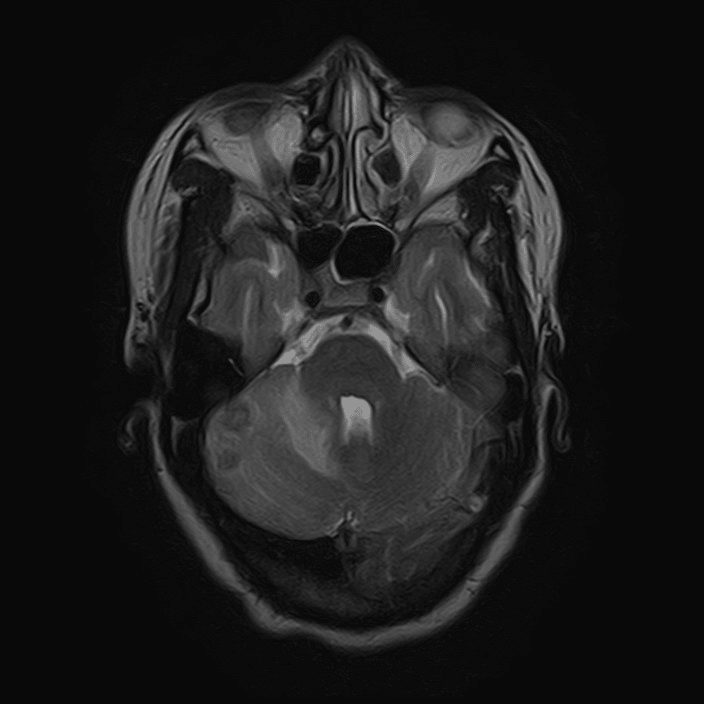
Lesões cerebelosas direitas em ressonância magnética T2
BIBLIOGRAFIA
1.Global tuberculosis report 2021. Organização Mundial de Saúde; 2021.
2.Programa Nacional para a Tuberculose. Relatório de vigilância e monitorização da tuberculose em Portugal – dados definitivos 2018/19. Lisboa: Direção Geral da Saúde; 2020.
3.Schaller MA, Wicke F, Foerch C, Weidauer S. Central nervous system tuberculosis : etiology, clinical manifestations and neuroradiological features. Clin Neuroradiol. 2019 Mar;29(1):3-18. doi: 10.1007/s00062-018-0726-9.
4.Bernaerts A, Vanhoenacker FM, Parizel PM, Van Goethem JW, Van Altena R, Laridon A et al. Tuberculosis of the central nervous system: overview of neuroradiological findings. Eur Radiol. 2003 Aug; 13(8):1876-90. doi: 10.1007/s00330-002-1608-7.
5.Katti MK. Pathogenesis, diagnosis, treatment, and outcome aspects of cerebral tuberculosis. Med Sci Monit. 2004 Sep; 10(9):RA215-229. PMID: 15328498.
6.Rock RB, Olin M, Baker C, Molitor T, Peterson P. Central nervous system tuberculosis: pathogenesis and clinical aspects. Clin Microbiol Rev. 2008 Apr; 21(2):243-61. doi: 10.1128/CMR.00042-07.
7.Nelson CA, Zunt JR. Tuberculosis of the central nervous system in immunocompromised patients: HIV infection and solid organ transplant recipients. Clin Infect Dis. 2011 Nov; 53(9):915-26. doi: 10.1093/cid/cir508.
8.Leonard J. Central nervous system tuberculosis. Microbiol Spectr. 2017; 5(2). doi: 10.1128/microbiolspec.TNMI7-0044-2017.
9.Chou PS, Liu CK, Lin RT, Lai CL, Chao AC. Central nervous system tuberculosis: a forgotten diagnosis. Neurologist. 2012 Jul; 18(4):219-22. doi: 10.1097/NRL.0b013e3182610347.
10.Zein T, Fletcher P, Mirghani Z. Intracranial tuberculoma. Neurosciences. 2000 Apr; 5(2):131-4.
11.Bayindir C, Mete O, Bilgic B. Retrospective study of 23 pathologically proven cases of central nervous system tuberculomas. Clin Neurol Neurosurg. 2006 Jun; 108(4):353-357. doi: 10.1016/j.clineuro.2005.03.001.
12.Sanei Taheri M, Karimi MA, Haghighatkhah H, Pourghorban R, Samadian M, Delavar Kasmaei H. Central nervous system tuberculosis: an imaging-focused review of a reemerging disease. Radiol Res Pract. 2015;2015:202806. doi: 10.1155/2015/202806.
13.Yuzawa H, Hirose Y, Kimura T, Kimura S, Sugawara H, Yanagisawaet al. A case of cerebral tuberculoma mimicking neurocysticercosis. Acute Med Surg. 2017; 4(3):329-33. doi: 10.1002/ams2.272.
14.Programa Nacional para a Tuberculose. Manual de tuberculose e micobactérias não tuberculosas - recomendações. Lisboa: Direção Geral da Saúde; 2020.
15.Vidal J, Hernández A, Oliveira A, Souza A, Madalosso G, Silva Pet al. Cerebral tuberculomas in AIDS patients: a forgotten diagnosis. Arq Neuro-Psiquiatr. 2004 Sept; 62(3b). doi: 10.1590/S0004-282X2004000500010.







